熔沸点最低的物质(2017年 高考化学第37题选考预测——物质的结构与性质)
Posted
篇首语:卧疾丰暇豫,翰墨时间作。本文由小常识网(cha138.com)小编为大家整理,主要介绍了熔沸点最低的物质(2017年 高考化学第37题选考预测——物质的结构与性质)相关的知识,希望对你有一定的参考价值。
熔沸点最低的物质(2017年 高考化学第37题选考预测——物质的结构与性质)
[命题人的忠告]
1.熟练书写常见的4种金属及其离子的核外电子排布式:Cr、Fe、Cu、Zn。
2.掌握同周期元素第一电离能比较:同一周期元素的第一电离能随着原子序数的增大而呈增大趋势,但ⅤA>ⅥA>ⅣA,ⅡA>ⅢA>ⅠA。
3.牢记3种分子的杂化方式和空间构型:CH4:sp3杂化,正四面体;NH3:sp3杂化,三角锥形;H2O:sp3杂化,V形。
4.学会σ键与π键的判断方法:单键均为σ键;双键、三键中含有1个σ键,其余为π键。
5.掌握有关晶体计算的常用方法:运用分摊法正确确定晶胞中所含原子的个数。
[典例剖析]
(10分)钒(V)、砷(As)、镍(Ni)均为第四周期元素,钒位于ⅤB族,砷位于ⅤA族,镍位于Ⅷ族。请回答下列相关问题。
(1)基态钒原子的电子排布式为____________________,钒有+2、+3、+4、+5等几种化合价,这几种价态中,最稳定的是________价。
(2)砷与氯气反应可得到AsCl3、AsCl5两种氯化物。其中属于非极性分子的是________,AsCl3分子的中心原子杂化类型是________,分子的空间构型是________。
(3)高纯度砷可用于生产具有半导体“贵族”之称的新型半导体材料GaAs,镓(Ga)为第四周期ⅢA族元素,Ga与As相比,第一电离能较大的是________。
(4)镍和镧形成的一种合金具有储氢功能,该合金储氢后的晶胞如下图所示:
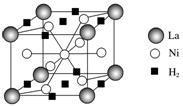
镍和镧形成的这种合金的化学式是_____________________________________________,
1 mol 镧形成的该合金能储存________mol氢气。

[挑战满分](限时30分钟)
1.氮族元素包括氮、磷、砷等元素。
(1)砷的基态原子的价电子排布式是________;砷与氯可形成AsCl5,AsCl5中含有________对成键电子对。
(2)下列关于该元素的说法中正确的是________(填字母选项)。
a.氮、磷、砷的电负性依次减小
b.氮、磷、砷的气态氢化物分子的稳定性依次减弱
c.N—H、P—H、As—H键的键长依次增长,而键的极性依次降低
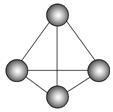
d.P4分子的空间构型为正四面体(如图),P—P键之间的键角为109°28′
(3)氮是化肥中的主要元素,某种盐类物质是常见的氮肥成分,其中氮元素同时显示最高化合价和最低化合价,请写出该物质的化学式:___________________________________________。
该化合物的组成元素中基态原子的第一电离能最大的是________(填元素符号)。
(4)磷元素的原子核外共有________种不同运动状态的电子、________种不同能级的电子。在形成PH3分子时,磷原子的中心原子轨道发生________杂化。
(5)如图为某种冰的一种骨架形式,以此为单位向空间延伸。
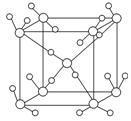
①该冰中的每个水分子有________个氢键;
②在气相中NH3易与H2O通过氢键以加合物形式存在,试写出加合物NH3·H2O的结构式:________________________________________________________________________
________________________________________________________________________。

2.锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式:__________________________________,
上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为_______________________。
(2)PO的空间构型是_______________________________________。
(3)与NH3互为等电子体的分子、离子有___________________________________、
________________(各举一例)。
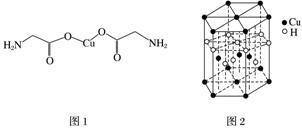
(4)氨基乙酸铜的分子结构如图1,碳原子的杂化方式为
________________________________________________________________________。
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol [Cu(CN)4]2-中含有的σ键的数目为________。
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图2所示,则该化合物的化学式为________________________________________________________________________。
答案 (1)[Ar]3d9 O<N
(2)正四面体
(3)PH3或AsH3 H3O+或CH
(4)sp3、sp2
(5)8NA
(6)CuH

3.钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:
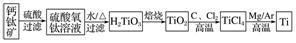
回答下列问题:
(1)基态钛原子的价电子排布图为_______________________________________________,
其原子核外共有________种运动状态不相同的电子,金属钛晶胞如图1所示,为________________堆积(填堆积方式)。
(2)已知TiCl4在通常情况下是无色液体,熔点为-37 ℃,沸点为136 ℃,可知TiCl4为________晶体。
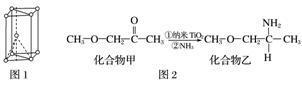
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2。化合物乙的沸点明显高于化合物甲,主要原因是_____________________________________________________。
化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为______________________。
(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图3所示。该阳离子Ti与O的原子数之比为______,其化学式为_______________________________________。
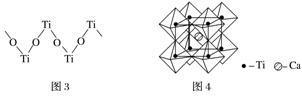
(5)钙钛矿晶体的结构如图4所示。钛离子位于立方晶胞的顶角,被________个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被________个氧离子包围,钙钛矿晶体的化学式为________________________________________________________________________。
答案 (1)

22 六方最密
(2)分子
(3)化合物乙分子间形成氢键 N>O>C
(4)1∶1 TiO2+(或[TiO])
(5)6 12 CaTiO3
解析 (1)Ti原子价电子为3d、4s上的电子,3d能级上有2个电子、4s能级上有2个电子;原子核外有几个电子其电子就有几种运动状态;该晶体为六方最密堆积。
(2)分子晶体熔、沸点较低。
(3)氢键的存在导致物质熔、沸点升高;同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第ⅡA族、第ⅤA族元素第一电离能大于其相邻元素。
(4)每个O原子被两个Ti原子共用、每个Ti原子被两个O原子共用,利用均摊法计算二者原子个数之比;Ti元素为+4价、O元素为-2价,据此书写其化学式。
(5)钛离子位于立方晶胞的顶角,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围;每个晶胞中钛离子和钙离子均为1个,晶胞的12个边长上各有一个氧原子,根据均摊原则计算各原子个数,从而确定化学式。
4.元素周期表第四周期中共有18种元素,请回答下列有关问题。
(1)金属钒(V)在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价电子排布式为________________________________________________________________________,
第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。但Ga的第一电离能却明显低于Zn的,原因是______________________。
(2)已知四溴化锗是电子工业中的一种常用试剂,其熔点为26.1 ℃,沸点为186 ℃,则GeBr4晶体的类型为________,中心原子的杂化类型为________。
(3)第四周期ⅤA~ⅦA族的元素中,电负性由大到小的顺序为___________(用元素符号表示)。
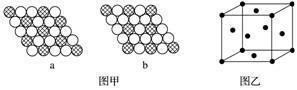
(4)如图甲所示为二维平面晶体示意图,所表示的物质化学式为AX3的是________(填“a”或“b”)。图乙为金属铜的晶胞,此晶胞立方体的边长为a pm,金属铜的密度为ρ g·cm-3,则阿伏加德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。

5.氮、氧、磷、铁是与生命活动密切相关的元素。回答下列问题:
(1)P的基态原子核外电子具有的原子轨道数为______,Fe3+比Fe2+稳定的原因是_________。
(2)N、O、P三种元素第一电离能最大的是________,电负性最大的是________。
(3)含氮化合物NH4SCN溶液是检验Fe3+的常用试剂,SCN-中C原子的杂化类型为________________________________________________________________________,
1 mol的SCN-中含π键的数目为________NA。
(4)某直链多磷酸钠的阴离子呈如图1所示的无限单链状结构,其中磷氧四面体通过共用顶点的氧原子相连,则该多磷酸钠的化学式为___________________________。
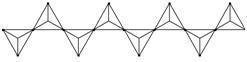
图1
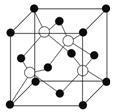
图2
(5)FeO、NiO的晶体结构与NaCl晶体结构相同,其中Fe2+与Ni2+的离子半径分别为7.8×10-2 nm、6.9×10-2 nm,则熔点FeO________(填“<”、“>”或“=”)NiO,原因是________________________________________________________________________。
(6)磷化硼是一种超硬耐磨的涂层材料,其晶胞如图2所示。P原子与B原子的最近距离为a cm,则磷化硼晶胞的边长为________ cm(用含a的代数式表示)。
答案 (1)9 Fe3+的价电子排布式为3d5,处于半充满状态,结构稳定
(2)N O
(3)sp 2

相关参考