焙烧碳酸锰制取二氧化锰(高三学生最怕的化工流程题——经典必做题型(精选))
Posted
篇首语:不学习历史的人注定要重复错误。——丘吉尔本文由小常识网(cha138.com)小编为大家整理,主要介绍了焙烧碳酸锰制取二氧化锰(高三学生最怕的化工流程题——经典必做题型(精选))相关的知识,希望对你有一定的参考价值。
焙烧碳酸锰制取二氧化锰(高三学生最怕的化工流程题——经典必做题型(精选))
化学《工艺流程》专题训练
1.我国是干电池的生产和消费大国。某科研团队设计了以下流程对碱性锌锰干电池的废旧资源进行回收利用:
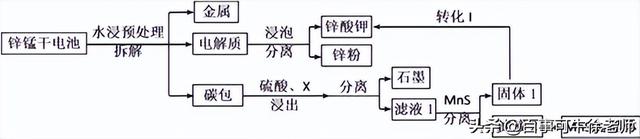
已知:①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
⑴碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+ Zn+2KOH= 2MnOOH+K2ZnO2,请写出电池的正极反应式______ _______;
⑵为了提高碳包的浸出效率,可以采取的措施有________________________;(写一条即可)
⑶向滤液1中加入MnS的目的是__________________________________________;
⑷已知MnSO4的溶解度曲线如图所示,从滤液2中析出MnSO4·H2O晶体的操作是蒸发结晶、____________________、洗涤、低温干燥;
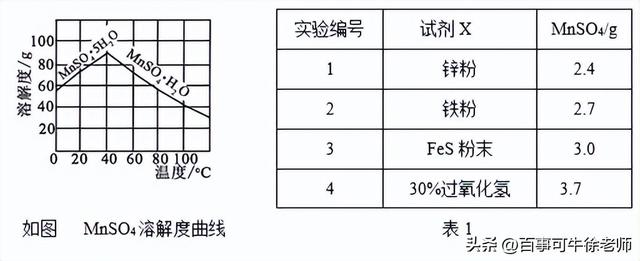
⑸为了选择试剂X,在相同条件下,分别用3 g碳包进行制备MnSO4的实验,得到数据如表1,请写出最佳试剂X与碳包中的主要成分发生反应的化学方程式_____________。
⑹工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是__________;
⑺该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定测定Mn2+在电池中的百分含量,化学方程式可以表示为Mn2++Y2-=MnY。实验过程如下:
准确称量一节电池的质量平均为24.00g,完全反应后,得到200.00mL滤液2,量取10.00mL滤液2稀释至100.00mL,取20.00mL溶液用0.0500mol•L-1EDTA标准溶液滴定,平均消耗标准溶液22.00mL,则该方案测得Mn元素的百分含量为________。(保留3位有效数字)
2.硫、铁的化合物有广泛的应用。
(1)过二硫酸铵(NH4)2S2O8可以看成双氧水的衍生物,H2O2分子中的两个H原子被—SO3H基取代后即为过二硫酸。
①(NH4)2S2O8中硫元素的化合价为_________;
②用过二硫酸铵溶液检测废水中的Mn2+,配平下面的离子反应:
__S2O82-+__Mn2++__=___MnO4-+__SO42-+____。
(2)大苏打的成分是Na2S2O3·5H2O,常用于防毒面具中吸收氯气。若1 mol Na2S2O3完全反应,失去8mol电子。写出其水溶液吸收氯气的离子方程式______________。
(3)磁性材料A是由两种元素组成的化合物,某研究小组按如图所示流程探究其组成:
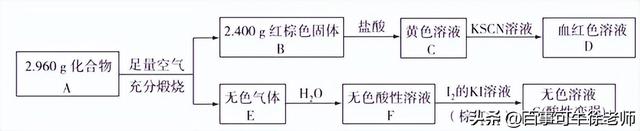
①A的化学式为____________;
②已知化合物A能与盐酸反应,生成一种淡黄色不溶物和一种气体(标准状况下密度为1.518g/L),写出该反应的离子方程式:_______________________。
3.碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
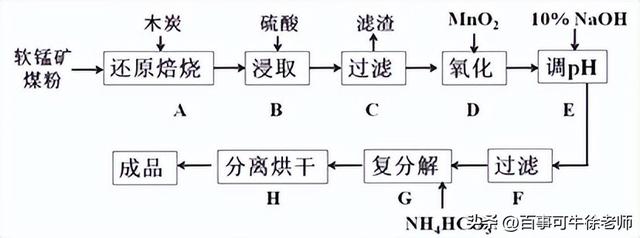
已知:还原焙烧主反应为:2MnO2+C

2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
(1)在实验室进行步骤A,需要用到的仪器为________________,步骤B中若采用质量分数为35%的硫酸(密度ρ=1.26 g/cm3),则其物质的量浓度为_________。
(2)步骤C中得到的滤渣主要成分是_______________,步骤D中还原剂与氧化剂的物质的量之比为 。
(3)步骤E中调节pH的范围为________,其目的是_____________________________。
(4)步骤G的离子方程式为_______________,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=__________。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:
Mn2++S2O82-+H2O=H++SO42-+MnO4-,
①请配平上述离子方程式____________________________;
②确认Mn2+离子已经完全反应的现象是_______________________________。
4.铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态,铈的合金耐高温,可以用来制造喷气推进器零件。请回答下列问题:
(1)雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(二者物质的量之比为1:1),该反应氧化剂与还原剂的物质的量之比为________。
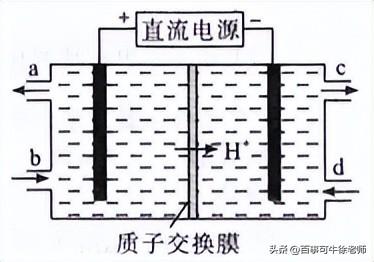
(2)可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。
①Ce4+从电解槽的______(填字母序号)口流出。
②写出阴极的电极反应式________________。
(3)铈元素在自然界中主要以氟碳矿形式存在。主要化学成分为CeFCO3。工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:
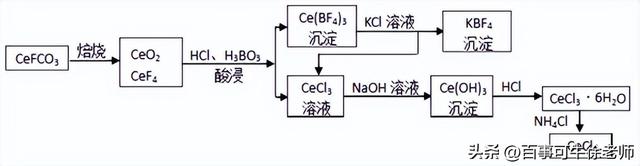
①焙烧过程中发生的主要反应方程式为__________________。
②有同学认为酸浸过程中用稀硫酸和H2O2替换盐酸更好,他的理由是_________。
③Ce(BF4)3、KBF4的Ksp分别为a、b,则Ce(BF4)3(s)+3KCl(aq)
3KBF4(s)+CeCl3(aq)平衡常数为________(用a、b的代数式表示)。
④加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是______。
5.以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
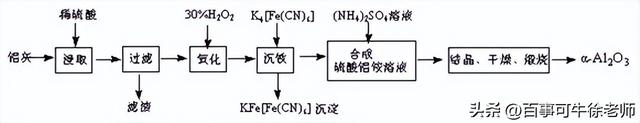
(1)铝灰中氧化铝与硫酸反应的化学方程式为____________________。
(2)图中“滤渣”的主要成分为________________(填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为____________________。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]
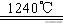
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
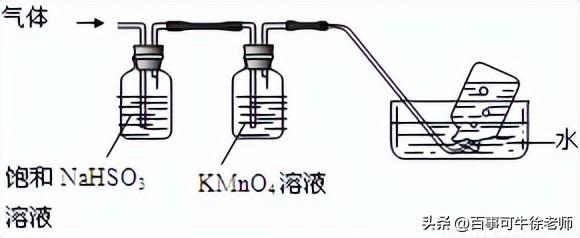
①集气瓶中收集到的气体是_______________(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有________________(填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为___________。
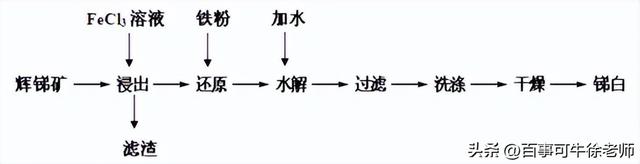
6.锑白(Sb2O3)在工业中有着广泛的作用。用辉锑矿(主要成分为Sb2S3,还含有少量SiO2)制备锑白的两种工艺如下:
I.火法制取锑白,是将辉锑矿装入氧化炉的坩埚中,高温使其熔化后通入空气,充分反应后,经冷却生成锑白。写出火法制取锑白的化学方程式:________________________________________。
Ⅱ. 湿法制取锑白的工艺流程如图:
已知:
①Sb3+与Fe2+的氧化性强弱相当
②常温下:
化合物 | Fe(OH)2 | Fe(OH)3 | Sb(OH)3 |
Ksp近似值 | 8×10-16 | 4×10-26 | 4×10-42 |
③Sb2O3为白色粉末,不溶于水,溶于酸和强碱。
④水解时保持溶液的c(H+)=0.1~0.3mol/L
(1)浸出是将辉锑矿溶于FeCl3溶液,请写出其中发生的氧化还原反应离子方程式___________________。滤渣的成分为______________________。
(2)采用铁粉作为还原剂进行还原,其目的是除去溶液中的离子___________(填离子符号),还原反应结束后,可用______________溶液来检验还原是否彻底。
(3)SbCl2是无色晶体,100升华,分子中所有原子都达到8e-稳定结构,请写出SbCl2的电子式__________。
水解是利用SbCl2的水解反应制取Sb2O3(SbCl2的水解分为多步),其反应可以简单表示为:
SbCl3+3H2O
Sb(OH)2+3HCl,2Sb(OH)2=Sb2O3+3H2O
为了促进水解趋于完全,可采取的措施(填两点):_____________________
(4)简述检验沉淀是否洗净的实验方法:__________________________________________。
(5)若不加铁还原,则最终所得锑白的产率将__________________(填“增大”、“减小”或“不变”)。
7.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
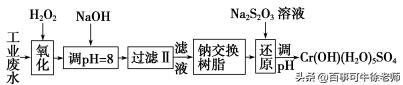
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗172.8g Cr2O72-转移4.8 mol e-,该反应离子方程式为___________。
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-==Fe2+,阴极反应式是2H++2e-==H2↑。
(1)电解时能否用Cu电极来代替阳极上的Fe电极?________(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因_______。
(4)若溶液中初始含有0.1mol Cr2O72-,则生成的阳离子全部转化化成沉淀的质量是________g。
8.从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):

回答下列问题:
①在步骤i中产生的有毒气体可能有__________________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+沉淀完全,则溶液的pH为____________。
③步骤iv中,生成FeCO3的离子方程式是_________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_________________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:___________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是________________。
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:

若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用: 。
9.CoCl2· 6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、 Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2· 6H2O的工艺流程如下:
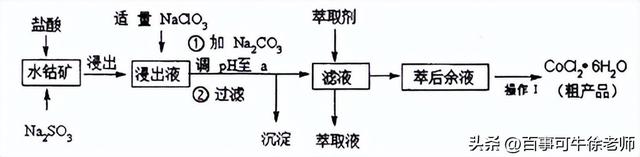
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表(金属离子浓度为0.01 mol/L):
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co (OH) 2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2· 6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中主要发生的离子反应方程式:______________。
(2)若不慎向“浸出液”中加过量NaC1O3时,可能会生成的有害气体是_______(填化学式)。
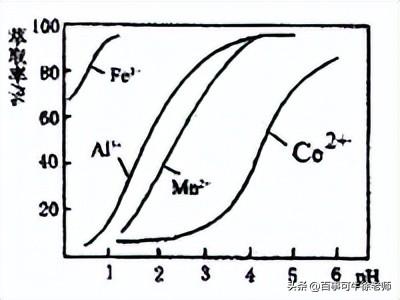
(3)萃取剂对金属离子的萃取率与pH的关系如图,向“滤液”中加入萃取剂的目的是_______,其使用的最佳pH范围是________(选填下列字母)。
A. 2.0~2.5 B. 3.0~3.5 C. 4.0~4.5 D. 5.0~5.5
(4) “操作1”是________。制得的CoCl2· 6H2O需减压烘干的原因是 。
(5)为测定粗产品中CoCl2· 6H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2· 6H2O的质量分数大于100%,其原因可能是___________________。(答一条即可)
10.硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
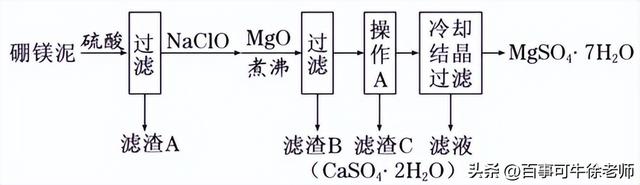
回答下列问题:
(l)Na2B4O7·10H2O中B的化合价为__________。
(2)Na2B4O7易溶于水,也易发生水解:B4O72-+7H2O
4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7 ,发生反应的化学方程式:______________。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式__________ __。
(4)加入MgO的目的是 。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取NaBH4,NaBH4被称为有机化学中的“万能还原剂”。
①写出NaBH4的电子式:___________。
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_________(保留两位小数)。
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式:________。
11.钼(Mo)是一种重要的过渡金属元素,常见化合价为+6、+5、+4,金属钼广泛用于冶金、机械制造、电子、照明及一些高科技领域。钼酸钠(Na2MoO4)是一种无公害型冷却水系统的金属缓蚀剂,也可用于制造生物碱、油墨、化肥、钼红颜料等。如图是化工生产中制备金属钼和钼酸钠的主要流程图,已知钼精矿的主要成分为MoS2,钼酸难溶于水。
(1)MoS2焙烧时反应的化学方程式为 ;产生的尾气对环境的主要危害是 。
(2)操作l中,粗产品中的MoO3
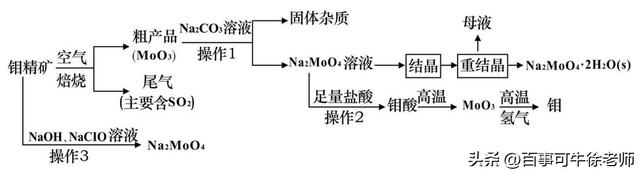
与Na2CO3溶液充分反应后,生成Na2MoO4和另外一种物质,该物质的电子式为 。粗产品经过充分碱浸后所得的碱浸液中部分离子的浓度:c(
)=0.40 mol·L−1,
c(
)=0.05mol·L−1。结晶前应先除去
,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,
的去除率为 。
[已知:Ksp(BaSO4)=1.1×10−10,Ksp(BaMoO4)=4.0×10−8]
(3)该流程中操作2为过滤,如果在实验室模拟该操作时,发现滤液中有少量浑浊,从实验操作的角度分析,可能的原因是 。
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因
。
(5) 工业上由MoO3制备Mo粉也常用铝热反应,写出该反应的方程式 。
(6)操作3在碱性条件下,将钼精矿加入到足量的NaClO溶液中,也可以制备钼酸钠。该反应的离子方程式为 。
12、“钢是虎,钒是翼,钢含钒犹如虎添翼”,金属钒被誉为“合金的维生素”。从废钒(主
要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:
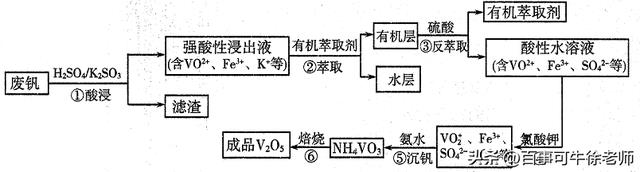
已知:步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)。
回答下列问题:(1)步骤①酸浸过程中发生氧化还原反应的化学方程式为______________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤25°C时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
通过表中数据分析,在实际生产中,⑤中加入氨水,调节溶液的最佳pH范围为______;
若加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为VO+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取率=
相关参考
...工流程的目的,更快更好的得到更纯的产品,有利于提炼学生宏观辨识与微观探析的素养。2018年全国I卷工艺流程题的四线呈现情况、信息呈现形式
混批手提风机(锂盐生产干货:锂云母生产电池级碳酸锂全流程说明)
锂云母生产电池级碳酸锂主要包括混料及焙烧系统、浸出过滤系统、碳酸锂生产系统三大环节,现在简单介绍如下:一、混料焙烧系统(包括:1.1锂云母原料卸料输送及预处理,1.2混料,1.3焙烧工段,1.4冷却)1.1锂云母原料卸料...
混批手提风机(锂盐生产干货:锂云母生产电池级碳酸锂全流程说明)
锂云母生产电池级碳酸锂主要包括混料及焙烧系统、浸出过滤系统、碳酸锂生产系统三大环节,现在简单介绍如下:一、混料焙烧系统(包括:1.1锂云母原料卸料输送及预处理,1.2混料,1.3焙烧工段,1.4冷却)1.1锂云母原料卸料...
氯元素的相对原子质量(九年级化学期中检测(实验题、计算题),试试你是否达标?)
...取氧气的装置图,回答下列问题(2)若用过氧化氢和二氧化锰制取氧气,二氧化锰是该反应的,该反应的文字表达式为,应选取的收集装置是或。(填序号),(3)若用高锰酸钾制取氧气,应选用的发生装置(填序号),在该...
1、橘子、橘子等柑桔类水果中富含丰富的纤维素以及多种营养物质,这些物质能够有效的促进胃肠吸收和消化,可有效的防治便秘的病发。2、梨、梨的水分和纤维含量高,是一个很好的肠道运动调节器,有助于治疗消化系统,...
...镁,铝,汞等金属8.黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9.红褐色固体:氢氧化铁10.白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(...
...镁,铝,汞等金属8.黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9.红褐色固体:氢氧化铁10.白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(...
氧气和臭氧化学性质相似吗(2019初中化学推断题突破口以及需要记忆的常识,总结得很好)
...镁,铝,汞等金属8.黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9.红褐色固体:氢氧化铁10.白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁(...
水玻璃与二氧化碳反应(初三化学上册,稀盐酸或稀硫酸与大理石反应制取二氧化碳实验讲解)
二氧化碳的实验室制取方法是中学化学学习的重点,主要是通过盐酸与大理石反应制取二氧化碳,也可通过稀硫酸与大理石在加热条件下反应来制取二氧化碳(一般不采用此方法),具体如下:一、盐酸与大理石反应制取二氧化...
1,制取原理碳酸钙(石灰石或大理石的主要成分是碳酸钙)与稀盐酸反应生成氯化钙,水和二氧化碳。2,实验装置固体与液体不加热型装置3,收集方法向上排空气法(因为二氧化碳密度比空气大)4,检验和验满燃着的木条熄...