烯烃的硼氢化氧化机理(全合成“出马”,对映异构辨真假)
Posted
篇首语:努力到无能为力,拼搏到感动自己本文由小常识网(cha138.com)小编为大家整理,主要介绍了烯烃的硼氢化氧化机理(全合成“出马”,对映异构辨真假)相关的知识,希望对你有一定的参考价值。
烯烃的硼氢化氧化机理(全合成“出马”,对映异构辨真假)
本文来自微信公众号:X-MOLNews
对于合成化学和药物化学的研究者来说,新颖的天然产物结构往往让人痴迷,比如本文中xestocyclamine A((-)-1, 图1),它是一个含有杂原子、桥环、不饱和双键的多环生物碱,并且结构立体、环环相扣,不但有桥头碳、氮原子“提纲挈领”,还有3个双键嵌合其中,堪称大自然化学合成中的“艺术”。有趣的是,这件精妙的艺术品并不孤独,它还有一个“孪生姊妹”——ingenamine((+)-3, 图1)。

图 1. (-)-keramaphidin B和(+)-keramaphidin B生物起源推测,以及报道的xestocyclamine A和ingenamine的结构。图片来源:J. Am. Chem. Soc.
自从这两个化合物被分离出来后,人们就推测了它们的生物起源:认为它们可能是源于含有3-烷基吡啶单元的大环二聚体A,通过跨环“Diels-Alder”反应生成中间体B,B再被还原为天然产物(-)-keramaphidin B((-)-2, 图1)。然而,令人疑惑不解的是,(-)-keramaphidin B在自然界中存在对映异构体 (+)-keramaphidin B((+)-2, 图1),而与(-)-keramaphidin B和(+)-keramaphidin B结构最相似的一对类似物却是上文提到的一对假对映异构体xestocyclamine A 和ingenamine。说它们“假”,是因为它们在11元环内双键的位置不同,前者在22、23位,后者在23、24位。这就很奇怪了,结构如此相似的两对天然产物,一对是镜像对称异构体,一对却是镜像假对称异构体,事出蹊跷则很可能有谬误,那么如何确定正确结构呢?剧情到这个时候,就该请全合成出马了。
虽然这两对天然产物及其衍生物本身均具有重要的生物研究价值,但是其结构成谜并且合成也充满挑战:尽管化学家进行了大量的条件优化,(-)-keramaphidin B和(+)-keramaphidin B的体外仿生合成产率依然很低;xestocyclamine A和ingenamine更是自发现后25年来还从未进行过全合成研究。直到最近,德国马克斯普朗克煤炭研究所的Alois Fürstner教授(点击查看介绍)研究团队才攻克了这一全合成挑战,通过化学全合成解开了化合物结构解析的谜团,证实xestocyclamine A就是ingenamine真正的对映异构体,而不是此前说的假对映异构体。相关成果发表在J. Am. Chem. Soc. 上,第一作者为孟占朝(Zhanchao Meng)博士。

Alois Fürstner教授。图片来源:马普所
2002年,Danishefsky课题组通过精巧的“Diels-Alder/缝合”环化策略形成了含氮四环骨架,并通过“烷基-Suzuki”偶联反应实现了11个单位的大环闭合,合成了xestocyclamine A中的五环核心骨架(Angew. Chem. Int. Ed., 2002, 41, 1581-1584,图2)。在此基础上,Fürstner教授课题组以xestocyclamine A为首要合成目标。在设计合成路线时,他们考虑到以下几点:(1)优选考虑用化学上正交的方法学实现两个大环的连续关环;(2)如果此前成功的“烷基-Suzuki”关环反应以某种形式保留在合成路线中,最好同时伴随着炔烃关环复分解反应(RCAM);(3)理想状态下,选择能够有利于大环闭合的合成模块;(4)无论选择哪种方法,都必须能够控制包含桥头季碳的结构边缘立体中心;(5)跨环策略在熵值和空间取向上存在一定的不足,因此可能并不合适。
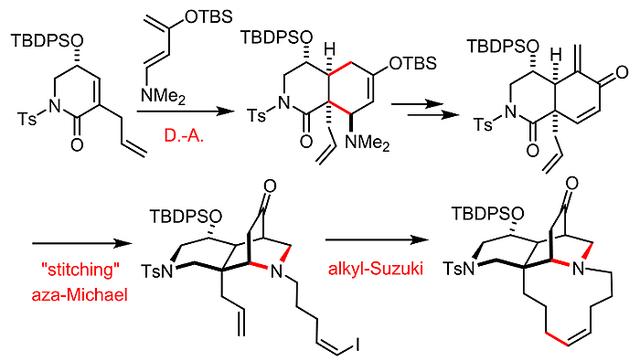
图2. Danishefsky课题组的合成研究路线。图片来源:J. Am. Chem. Soc.
作者进行了逆合成分析:用H和I型化合物作为前体,通过Michael/Michael 级联反应,使H的高亲电性能够在邻位立体中心的立体化学控制下,为第一个C-C键的形成提供动力。同时,这一关键步骤能够产生优良的Michael供体G,后者可以和亲电性较差的化合物反应,从而形成了适度官能化的桥连二氮杂环片段F。而化合物F再通过E、D、C中间体最终形成目标化合物1(图3)。

图3. 逆合成分析路线。图片来源:J. Am. Chem. Soc.
接下来,作者开始合成H型化合物6和I型化合物9。先前的研究曾报道过化合物6需要9步才能合成(Tetrahedron, 1995, 51, 5935-5950),而他们在本文中改进了化合物6的合成步骤(图4):从化合物4出发,通过O-硅基化和区域选择性的C-H键氧化合成内酰胺化合物5(两步总收率:55%,ee值:> 99%),且这两步都能以>18 g 的规模进行。随后,用过量的LiHMDS将5去质子化并依次添加氯甲酸烯丙酯、PhSeCl,将所得的产物在严格中性的条件下用双氧水处理,以76%的收率得到化合物6。同时,他们从化合物7开始,通过酰化/烷基化反应得到化合物8,后者在Pd2(dba)3·CHCl3的作用下脱羧脱氢得到化合物9。
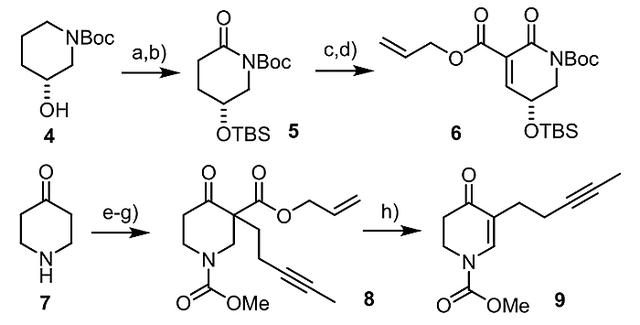
图4. 化合物6和9的制备路线。图片来源:J. Am. Chem. Soc.
得到化合物6和9后,他们开始进行Michael/Michael 级联反应。然而与预料相反,Michael/Michael反应并没有以级联反应的方式进行,这是因为在强碱LiHMDS的存在下第二步反应是可逆的。幸运的是,通过改变碱试剂产生了化合物11。具体而言,化合物9经LiHMDS去质子化后生成的烯醇盐与受体6反应生成化合物10,光谱数据表明10是C2位异构体的混合物,但是其对C1位的立体化学具有关键性的控制。向该混合物中加入K2CO3,并在MeCN中回流,通过分子内Michael 加成生成笼状结构11,后者可从C2位异构体中分离出来。随后,经钯催化的脱羧烯丙基化产生化合物12,12桥环上的酮羰基通过NaBH4还原产生单一的非对映异构体醇。随后的消除反应经历了一系列艰难的探索,最终发现甲磺酸衍生物13与2,6-二甲基吡啶在170 ℃下反应,成功地产生烯烃产物14,收率72%。14在7-碘-2-庚烷的作用下进行N-烷基化形成产物15,后者在双组分催化体系(由化合物17和18组成)下,通过RCAM反应产生化合物16,至此目标产物的第一个大环完成关环(图5)。
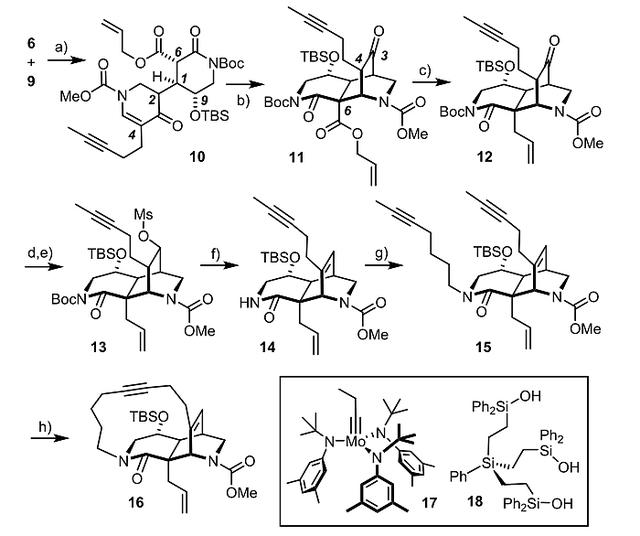
图5. 化合物16的合成路线。图片来源:J. Am. Chem. Soc.
接着,他们用过量的 L-Selectride来脱除16的氨基甲酸甲酯,随后通过还原性N-烷基化形成产物20。在Danishefsky课题组研究的启发下,他们用过量的9-H-9-BBN处理化合物20,区域选择性地在末端烯烃和内炔上进行硼氢化,得到化合物21,由于Csp3-BBN键比Csp2-BBN键稳定,因此添加稀HOAc会选择性地在21的烯基硼烷上发生质子分解,产生化合物22(保持12、13位烯烃双键为Z式,24位供体完整)。过量的酸用NaHCO3淬灭,混合物用THF稀释,并将所得的含22的溶液缓慢加入到含催化剂[(dppf)PdCl2]、AsPh3和Tl2CO3的THF/DMF/H2O溶液中,以48%的总收率生成产物23,标志着完成了第二个大环关环。最后通过内酰胺还原、脱保护,生成目标产物(-)-1。并通过波谱分析和单晶X-射线衍射证实(-)-1与此前报道的xestocyclamine A结构一致(图6)。

图6. 目标化合物(-)-1的合成和晶体结构。图片来源:J. Am. Chem. Soc.
然而,(-)-1的游离碱和衍生盐(-)-1·2HCl的核磁数据与文献报道略有不同。考虑到前面提到的生物合成疑问,作者怀疑当年分离出这类化合物的课题组大概率在解析22、23位烯烃双键时出现谬误。他们推测xestocyclamine A要么就是ingenamine((+)-3),要么是ingenamine的对映异构体。
那么,如何去证明呢?答案还是全合成。他们选择化合物15作为起始原料,经末端烯烃的硼氢化/氧化、Wittig反应、N-脱保护、大环内酯化,以三步39%的总收率得到化合物28。后者经RCAM反应、炔烃还原、酮羰基还原(NaBH4)、硅基脱保护,最终得到了ent-ingenamine ((-)-3, 图7)。
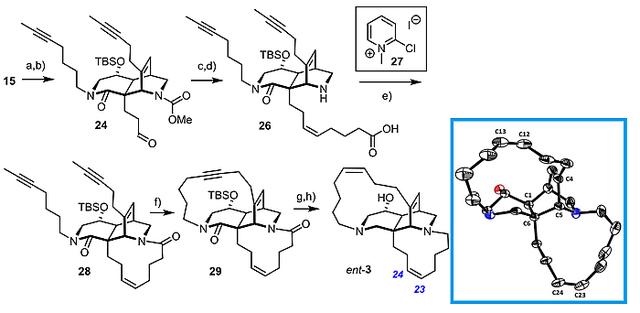
图7. 化合物(-)-3的全合成路线及和晶体结构。图片来源:J. Am. Chem. Soc.
有意思的是,(-)-3的核磁数据与严格无酸的天然产物ingenamine在[D4]-MeOH中的数据相匹配。由于在溶剂CDCl3/[D6]–DMSO中的光谱对溶剂比和痕量酸非常敏感,所以难以进行直接的比较。但是,当加入0.4当量的三氟乙酸时,(-)-3的核磁氢谱和碳谱重现了文献中报道的xestocyclamine A波谱数据,再结合这些样品的旋光数据,他们终于揭开了这个谜题:先前报道的xestocyclamine A结构解析有误,所有证据都倾向于它就是ingenamine的对映异构体。
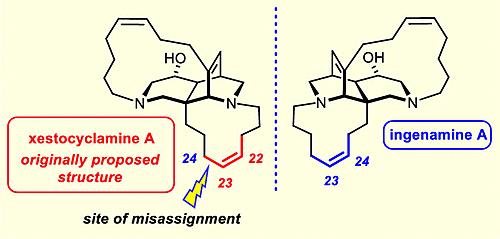
图8. 先前报道的xestocyclamine A结构解析有误。图片来源:J. Am. Chem. Soc.
总结
Alois Fürstner教授研究团队通过Michael/Michael级联反应、炔烃关环复分解、炔烃还原、酮羰基还原(NaBH4)、硅基脱保护等步骤实现了名义上xestocyclamine A((-)-1)的全合成,并且通过全合成揭示了先前文献中报道的xestocyclamine A的结构解析有误,证实了它就是ingenamine的对映异构体。
Total Synthesis Provides Strong Evidence: Xestocyclamine A is the Enantiomer of Ingenamine
Zhanchao Meng, Alois Fürstner
J. Am. Chem. Soc., 2020, 142, 11703-11708, DOI: 10.1021/jacs.0c05347
导师介绍
Alois Fürstner
https://www.x-mol.com/university/faculty/49815
(本文由水村山郭供稿)
相关参考
天津师大王超Nat.Commun.:非活化烯烃的区域、非对映选择性芳胺化反应本文来自微信公众号:X-MOLNewsC–C和C–N键是自然界中最重要的两个化学键,烯烃的芳胺化反应能在烯烃中同时引入芳基和胺基,在快速构建复杂分子、丰富分...
有机化学对映异构知识点(《中国大百科全书(第2版)》读书笔记5217-拆分)
...lution用物理、化学或生物化学的方法,从外消旋体中分离对映体(至少分离出此对对映体中的一种)的过程。左旋肉碱拆分方法有如下几种:直接分离①手工分离。分离方法限于堆集外消旋体。从结晶外形就能察觉到是对映形态...
有机化学第5章对映异构(围绕共价单键自主的化学燃料定向旋转)
围绕共价单键自主的化学燃料定向旋转文章出处:StefanBorsley,ElisabethKreidt,DavidA.Leigh,BenjaminM.W.Roberts.Autonomousfuelleddirectionalrotationaboutacovalentsinglebond.Nature2022,604,80-85.摘要:生物学通过自主的化学燃料分子机制运作,包括旋转马达,...
186、氧和臭氧的关系是(B)A、同位素B、同素异形体C、同分异构体D、同一物质187、氧气是我们身边常见的物质,以下有关氧气的叙述不正确的是(A)A、氧气具有可燃性B、氧气能提供动植物呼吸C、氧气能支持燃烧D、某些物质在空气...
一、单选题(20分)1.下列结构中,所有碳原子都是sp2杂化的是A.B.C.D.2.下列结构中,所有碳原子都在一条直线上的是A.B.C.D.3.下列化合物既能产生顺反异构,又能产生对对映异构的是A.B.C.D.4.下列物质能使KMn...
一、单选题(20分)1.下列结构中,所有碳原子都是sp2杂化的是A.B.C.D.2.下列结构中,所有碳原子都在一条直线上的是A.B.C.D.3.下列化合物既能产生顺反异构,又能产生对对映异构的是A.B.C.D.4.下列物质能使KMn...
烯烃硼氢化氧化(具有动力学立体控制的取代环己烷的模块化合成)
具有动力学立体控制的取代环己烷的模块化合成文章出处:YangyangLi,YuqiangLi,HongjinShi,HongWei,HaoyangLi,IgnacioFunes-Ardoiz,GuoyinYin.Modularaccesstosubstitutedcyclohexaneswithkineticstereocontrol.Science2022,376,749-753.摘要:取代六元环烃是生物活性化合物的...
烯烃硼氢化氧化(具有动力学立体控制的取代环己烷的模块化合成)
具有动力学立体控制的取代环己烷的模块化合成文章出处:YangyangLi,YuqiangLi,HongjinShi,HongWei,HaoyangLi,IgnacioFunes-Ardoiz,GuoyinYin.Modularaccesstosubstitutedcyclohexaneswithkineticstereocontrol.Science2022,376,749-753.摘要:取代六元环烃是生物活性化合物的...
重排反应是有机合成中很常见的一类反应。按反应机理,重排反应可分为:基团迁移重排反应和周环反应。基团迁移重排反应反应物分子中的一个基团在分子范围内从某位置迁移到另一位置的反应。常见的迁移基团是烃基。这类...
重排反应是有机合成中很常见的一类反应。按反应机理,重排反应可分为:基团迁移重排反应和周环反应。基团迁移重排反应反应物分子中的一个基团在分子范围内从某位置迁移到另一位置的反应。常见的迁移基团是烃基。这类...