漂粉精的主要成分(考前必看丨化学人教版「必修一」前两章知识点总结)
Posted
篇首语:与天地兮比寿,与日月兮齐光。本文由小常识网(cha138.com)小编为大家整理,主要介绍了漂粉精的主要成分(考前必看丨化学人教版「必修一」前两章知识点总结)相关的知识,希望对你有一定的参考价值。
漂粉精的主要成分(考前必看丨化学人教版「必修一」前两章知识点总结)
第一章 物质及其变化
一、物质的分类
1.根据物质的组成对物质进行分类
(1)由同一种元素形成的几种性质不同的单质,叫作这种元素的同素异形体。
金刚石、石墨和C60是碳元素的同素异形体;O2和O3是氧元素的同素异形体。
(2)树状分类法

(3)从不同的角度对物质进行分类——交叉分类法
2.根据物质的性质对物质进行分类
酸性氧化物:能与碱反应生成盐和水的氧化物,如CO2、SO2。大多数非金属氧化物属于酸性氧化物。
碱性氧化物:能与酸反应生成盐和水的氧化物,如CaO、Fe2O3。大多数金属氧化物属于碱性氧化物。
3.分散系
(1)基本概念

(2)分类
根据分散质粒子的直径大小分类:

4.胶体
(1)分类
按分散剂是液体、气体或固体,胶体可分为液溶胶(如氢氧化铁胶体)、气溶胶(云、雾)和固溶胶(有色玻璃)。
(2)Fe(OH)3胶体的制备
在小烧杯中,加入40 mL蒸馏水,加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热,即可制得Fe(OH)3胶体。化学方程式:
FeCl3+3H2O==加热==Fe(OH)3(胶体)+3HCl

(3)丁达尔效应
①原理:胶粒的直径为1~100 nm,能使光波发生散射。
②应用:可利用丁达尔效应区分胶体和溶液。
二、物质的转化
1.实现物质转化的基本依据:在化学变化过程中,元素不会发生改变。
2.单质到盐的转化关系

3.确定制取物质的方法
(1)确定依据
①物质的组成和性质
②物质之间的转化关系
(2)实例——碱的制备

(3)工业生产方法的选择
①最适当方法的选择

②实例——工业上制取NaOH
a.不采用Na2O与H2O反应的原因:Na2O作为原料,来源少、成本高;
b.主要采用方法:电解饱和食盐水;
c.过去曾采用方法:盐(如Na2CO3)与碱[如Ca(OH)2]反应。
三、电解质的电离
1.电解质
(1)概念:在水溶液里或熔融状态下能够导电的化合物叫作电解质。在水溶液里和熔融状态下都不能导电的化合物叫作非电解质。
(2)常见的电解质
①酸:HCl、H2SO4、HNO3、H2CO3等
②碱:KOH、NaOH、NH3·H2O、Mg(OH)2等
③盐:KCl、Na2SO4、Mg(NO3)2等
④金属氧化物:Na2O、CaO等
⑤水
(3)常见的非电解质
①大多数非金属氧化物:CO2、SO2、P2O5等
②NH3
③大多数有机物:蔗糖、酒精、CH4等
2.电离
(1)概念:电解质溶于水或受热熔化时,形成自由移动的离子的过程。
(2)强电解质和弱电解质
①强电解质:溶于水后全部电离,完全以离子形式存在,如强酸、强碱、大多数盐等;
②弱电解质:溶于水后部分电离,同时以离子和分子形式存在,如弱酸、弱碱、水等。
(3)酸、碱的本质:电离时生成的阳离子全部是氢离子的化合物叫做酸;电离时生成的阴离子全部是氢氧根的化合物叫做碱。
四、离子反应
1.离子反应
(1)概念
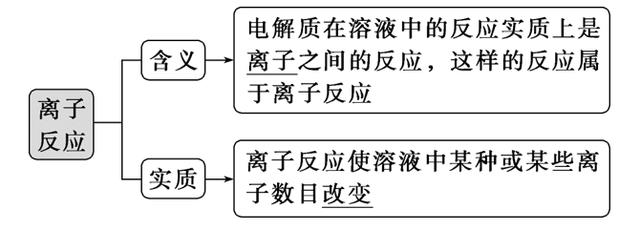
(2)发生条件
①生成气体、沉淀或水
②发生氧化还原反应
③生成络合物
2.离子方程式
(1)概念:用实际参加反应的离子符号来表示反应的式子。
(2)书写步骤(以Na2SO4溶液和BaCl2溶液的反应为例)
①写:正确书写反应的化学方程式
Na2SO4+BaCl2===BaSO4↓+2NaCl
②拆:把易溶的强电解质(如强酸、强碱和大部分可溶性盐)写成离子形式,难溶的强电解质、弱电解质和气体等仍用化学式表示:
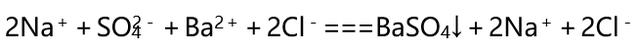
③删:删去方程式两边不参加反应的离子,并将方程式化为最简

④查:检查离子方程式两边各元素的原子个数和电荷总数是否相等
(3)意义
离子方程式不仅可以表示某个具体的化学反应,还可以表示同一类型的离子反应。
五、氧化还原反应
1.氧化还原反应

2.氧化还原反应与四种基本反应类型的关系

3.氧化还原反应中电子转移的表示方法
(1)双线桥法

(2)单线桥法

六、氧化剂和还原剂
1.氧化剂:在反应时,所含元素的化合价降低,即得到电子(或电子对偏向)的物质是氧化剂,具有氧化性,发生还原反应,生成还原产物。
2.还原剂:在反应时,所含元素的化合价升高,即失去电子(或电子对偏离)的物质是还原剂,具有还原性,发生氧化反应,生成氧化产物。
第二章 海水中的重要元素——钠和氯
一、活泼的金属单质——钠
1.钠的结构
钠原子最外层只有1个电子,在化学反应中很容易失去该电子。因此,钠的化学性质非常活泼,表现出强还原性。
2.钠的物理性质
钠很软,是一种银白色的金属,熔点低,密度比水小,常保存在煤油或石蜡油中。
3.钠的化学性质
(1)钠与氧气的反应

(2)钠与水的反应
①现象:钠浮在水面上,钠熔化成闪亮的小球,小球在水面上四处游动,与水反应发出“嘶嘶”的响声,溶液的颜色变红。
②解释:钠的密度比水小;钠熔点低,反应放热;反应产生气体推动小球运动;钠与水反应剧烈;反应生成碱性物质。
③化学方程式:2Na+2H2O===2NaOH+H2↑
二、钠的几种化合物
1.氧化钠
(1)物理性质:白色粉末状固体。
(2)化学性质:具有碱性氧化物的通性。
2.过氧化钠
(1)物理性质:淡黄色粉末状固体。
(2)化学性质
①与水反应

②与CO2反应

(3)用途:供氧剂、漂白剂。
3.碳酸钠和碳酸氢钠

三、焰色试验
1.定义:很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色,根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。焰色试验是物理变化。
2.常见金属的焰色
钾:紫色(需透过蓝色钴玻璃)、钠:黄色、锂:紫红色、锶:洋红色、钙:砖红色、钡:黄绿色、铜:绿色
四、氯气的性质
1.氯的结构
氯原子最外层有7个电子,在化学反应中很容易得到一个电子。氯气是很活泼的非金属单质,具有强氧化性。
2.氯的物理性质:氯气是一种黄绿色、有刺激性气味的有毒气体,密度比空气大,能溶于水。
3.氯的化学性质
(1)与金属、非金属单质反应

(2)与水的反应
氯气的水溶液称为氯水。在常温下,溶于水的部分氯气与水发生反应:
Cl2+H2O===HCl+HClO(次氯酸)
新制氯水成分:三分子(H2O、Cl2、HClO)四离子(H+、Cl-、ClO-、OH-)
次氯酸是一种比碳酸还弱的酸,具有强氧化性,能杀菌、消毒。次氯酸只存在于水溶液中,不稳定,见光易分解,化学方程式为2HClO==光照==2HCl+O2↑。因此氯水在久置过程中会逐渐变为稀盐酸。
(3)与碱的反应
①与氢氧化钠溶液反应——制取漂白液
Cl2+2NaOH===NaCl+NaClO+H2O
②与冷的石灰乳反应——制取漂白粉
2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O
漂白粉的主要成分是CaCl2、Ca(ClO)2,有效成分是Ca(ClO)2;漂粉精的主要成分是Ca(ClO)2,有效成分是Ca(ClO)2。
五、氯气的实验室制法

MnO2+4HCl(浓)==加热==MnCl2+2H2O+Cl2↑
六、氯离子的检验
取少量溶液于试管中,滴加足量稀硝酸酸化,然后滴加少量AgNO3溶液,产生白色沉淀(Ag++Cl-===AgCl↓),证明溶液中有氯离子。
七、物质的量的单位——摩尔
1.物质的量
(1)物质的量表示含有一定数目粒子的集合体,符号为n。摩尔是物质的量的单位,简称摩,符号为mol。
(2)国际上规定,1 mol粒子集合体所含的粒子数约为6.02×1023。
2.阿伏加德罗常数
(1)1 mol任何粒子的粒子数叫做阿伏加德罗常数,符号为NA,通常用6.02×1023mol-1表示。
(2)物质的量、阿伏加德罗常数与粒子数(N)之间的关系为n=N/NA。
3.摩尔质量
(1)1摩尔物质所具有的质量叫做摩尔质量,符号为M,常用单位为g/mol。摩尔质量以g/mol为单位时,在数值上等于该粒子的相对原子质量或相对分子质量。
(2)物质的量、质量和摩尔质量的关系为n=m/M。
八、气体摩尔体积
(1)阿伏加德罗定律:同温同压下,相同体积的任何气体都含有相同数目的粒子。
(2)1摩尔气体所占的体积叫做气体摩尔体积,符号为Vm。常用单位有L/mol(或L·mol-1)和m3/mol(或m3·mol-1)。
(3)气体摩尔体积、体积和物质的量的关系为Vm=V/n。
(4)标准状况下(0 ℃、101 kPa),气体摩尔体积约为22.4L/mol。
九、物质的量浓度
1.物质的量浓度
(1)物质的量浓度表示单位体积的溶液里所含溶质B的物质的量,符号为cB,常用单位为mol/L(或mol·L-1)。
(2)CB=nB/V ,其中V 指的是溶液的体积,而非溶剂的体积。
(3)物质的量浓度、密度、质量分数和溶质的摩尔质量之间的关系为CB=ρω/M
2.配制一定物质的量浓度的溶液
(1)容量瓶:用于配制一定体积、一定浓度的溶液。不能用容量瓶溶解固体或稀释浓溶液;容量瓶不能用作反应容器或长期存放溶液;选择容量瓶应遵循“大而近”的原则,即所配溶液的体积等于或略小于容量瓶的容积。
(2)操作步骤
计算→称量(量取)→溶解(稀释)→转移→摇晃→洗涤→定容→摇匀→装瓶贴签
3.溶液的稀释
c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液)
- 图片:NOBOOK虚拟实验
相关参考
...有机化合物包括糖类、脂质、蛋白质和核酸;其中糖类是主要能源物质,化学元素组成:C、H、O。蛋白质是干重中含量最高的化合物,是生命活动的主要承担者,化学元素组成:C、H、O、N、“S”。核酸是细胞中含量最稳定的,是...
当代中学生报化学必修一答案(人教版高中化学必修1:第1章 物质及其变化测试卷附答案)
我是超人老师,每天为大家更新小学、初中资料。如果觉得好的话,记得关注我哦。
...一定物质的量浓度溶液的配制二、知识网络 本章包括化学实验基本方法、化学计量在实验中的应用两节内容,其
当代中学生报数学必修一第四期答案(高中数学课后习题答案:最新教材人教A版(必修12+选修123))
「教材答案」快藏好啦!高中数学:必修1-5课后习题答案基础必备篇幅有限,文章仅为部分资料展示。高清完整版回复【资料】接下来进入正题。
日语动词1、浴びる「あびる」⓪动2他意味:沐浴;浇;蒙受例:シャワーを浴びる。(洗澡。)日语动词2、表れる「あらわれる」④动2自意味:表现;表现出例:本性が表れる。(露出本性。)日语动词3、合わせる「あわせる...
物理安装铁架台的顺序(人教版高中物理必修2,实验:验证机械能守恒定律导航,必备)
预习导航一、实验目的利用重物自由下落的现象验证机械能守恒定律。二、实验器材1.铁架台(带铁夹);2.打点计时器;3.重锤(带纸带夹子);4.纸带几条;5.复写纸片;6.导线;7.直尺;8.学生电源。三、实验原理在自由...
物理安装铁架台的顺序(人教版高中物理必修2,实验:验证机械能守恒定律导航,必备)
预习导航一、实验目的利用重物自由下落的现象验证机械能守恒定律。二、实验器材1.铁架台(带铁夹);2.打点计时器;3.重锤(带纸带夹子);4.纸带几条;5.复写纸片;6.导线;7.直尺;8.学生电源。三、实验原理在自由...
氧化铝属于什么晶体(期末必看——高中化学必修一知识点全归纳(第三章))
化学好教师化学好教师化学好教师为大家整理了高一必修一的全部知识点,希望可以帮助同学们好好复习,迎接期末考试!第三章金属及其化合物第一节金属的化学性质1.金属的物理通性有哪些?(1)金属在常温下的状态除汞...
《必修1分子与细胞》1.盐析在鸡蛋清中加入食盐会出现白色絮状物,高温加热后鸡蛋清会呈现白色固态状,导致蛋白质出现这两种情况的原理相同吗?说明理由。——[问题源于《必修1》P23“与生活的联系”]【提示】不同。在食...
《必修1分子与细胞》1.盐析在鸡蛋清中加入食盐会出现白色絮状物,高温加热后鸡蛋清会呈现白色固态状,导致蛋白质出现这两种情况的原理相同吗?说明理由。——[问题源于《必修1》P23“与生活的联系”]【提示】不同。在食...