溶解度指明(2017中考化学试题研究复习--命题点7溶解度和溶解度曲线试题)
Posted
篇首语:春衣少年当酒歌,起舞四顾以笑和。本文由小常识网(cha138.com)小编为大家整理,主要介绍了溶解度指明(2017中考化学试题研究复习--命题点7溶解度和溶解度曲线试题)相关的知识,希望对你有一定的参考价值。
溶解度指明(2017中考化学试题研究复习--命题点7溶解度和溶解度曲线试题)
第一部分 考点研究
模块一 身边的化学物质
命题点7 溶解度和溶解度曲线
(时间:40分钟 分值:32分)
eq \\x(类型一) 溶解度表格
下表列出了氯化铵在不同温度下的溶解度,下列说法错误的是( )
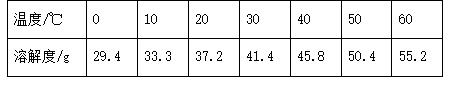
A. 20 ℃时,氯化铵的溶解度为37.2 g
B. 10 ℃时,将16 g氯化铵加入到50 g水中,形成的是饱和溶液
C. 表中所列的溶解度对应的溶剂质量均为100 g
D. 分析数据得出,氯化铵的溶解度受温度影响较大
2. (2016合肥45中一模)下表是KCl和KNO3在不同温度下的溶解度。下列说法不正确的是( )
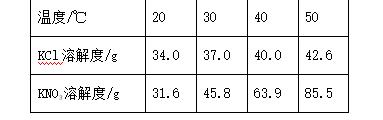
A. 20 ℃时,KCl的溶解度大于KNO3的溶解度
B. 40 ℃时,5 g KCl中加10 g水可得33.3%溶液
C. 两种物质溶解度相等的温度在20 ℃~30 ℃之间
D. 50 ℃时,10 g KNO3中加20 g水,充分溶解后再降温到30 ℃,有KNO3固体析出
eq \\x(类型二) 一条溶解度曲线
3. (2016泉州)如图是硝酸钾的溶解度曲线,下列说法错误的是( )
A. 硝酸钾的溶解度随温度的升高而增大
B. 降低温度可以使接近饱和的硝酸钾溶液变饱和
C. 60 ℃时120 g硝酸钾与100 g水充分混合可以形成饱和溶液
D. 60 ℃时硝酸钾溶液的溶质质量分数一定大于30 ℃时硝酸钾溶液的溶质质量分数
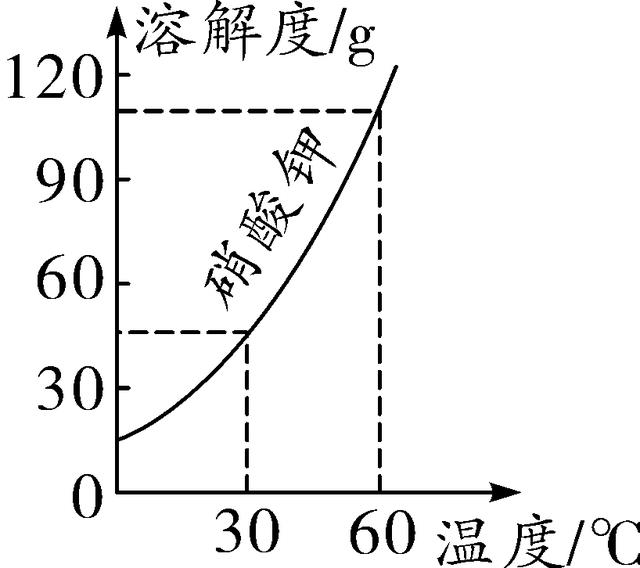
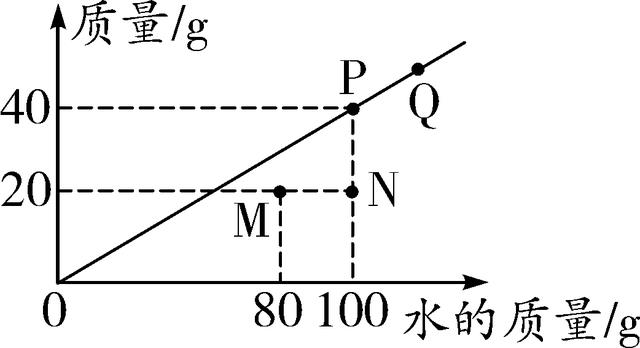
第3题图 第4题图
4. (2016蚌埠九中一模)t ℃时,测得在不同质量的水中溶解某物质(不含结晶水)达到饱和状态时的质量绘制成如图中斜线。下列说法正确的是( )
A. t ℃时该物质的溶解度为40
B. P、Q点处溶液中溶质的质量分数相等
C. N点表示溶液中溶质的质量分数为20%
D. 随着水质量的增加该物质的溶解度变大
5. (2016昆明)甲物质的溶解度(S)随温度(t)变化曲线如图所示,下列说法正确的是( )
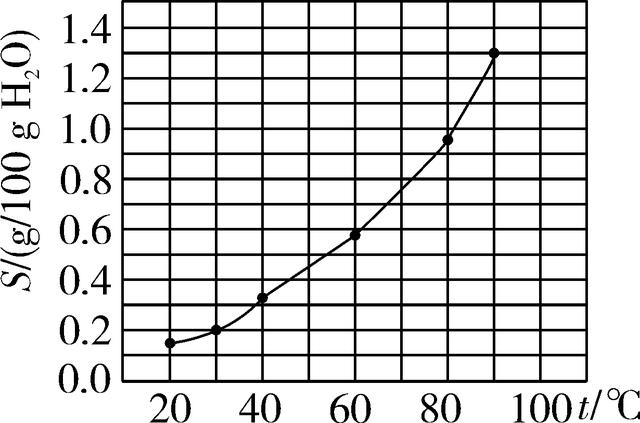
第5题图
A. 20 ℃时,甲易溶于水
B. 60 ℃时,甲的溶解度约为0.6
C. 将80 ℃时甲的溶液降温至40 ℃,一定析出甲晶体
D. 90 ℃时,在50 g水中加入0.7 g甲,充分搅拌后得到饱和溶液
6. (2016深圳)如图为某物质的溶解度曲线,下列说法正确的是( )
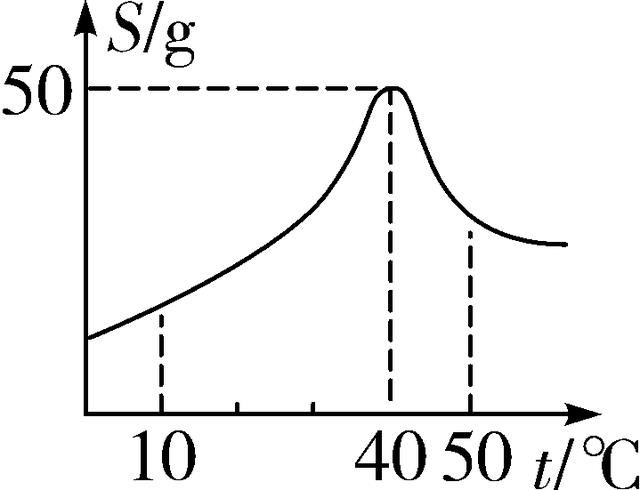
第6题图
A. 在40 ℃时,溶解的质量分数为50%
B. 在40 ℃时,饱和溶液升温可变成不饱和溶液
C. 40 ℃的饱和溶液降温至10 ℃,有固体析出
D. 50 ℃的饱和溶液升温至80 ℃,溶液由饱和溶液变为不饱和溶液
eq \\x(类型三) 两条溶解度曲线
7. (2016合肥六中一模)甲、乙两种物质的溶解度曲线如图所示。下列说法正确的是( )
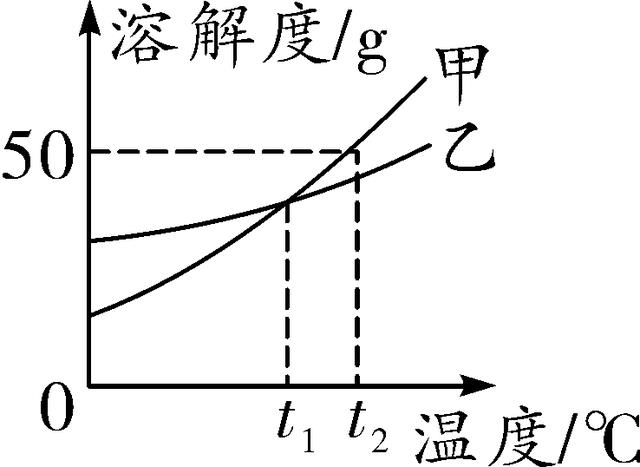
第7题图
A. 甲的溶解度大于乙的溶解度
B. 两种物质的溶解度都随温度升高而增大
C. t1℃时,甲、乙两种物质的溶液中,溶质质量分数相等
D. t2℃时,甲的饱和溶液溶质质量分数为50%
8. (2016梧州)如图是M、N两种固体物质的溶解度曲线,下列说法错误的是( )
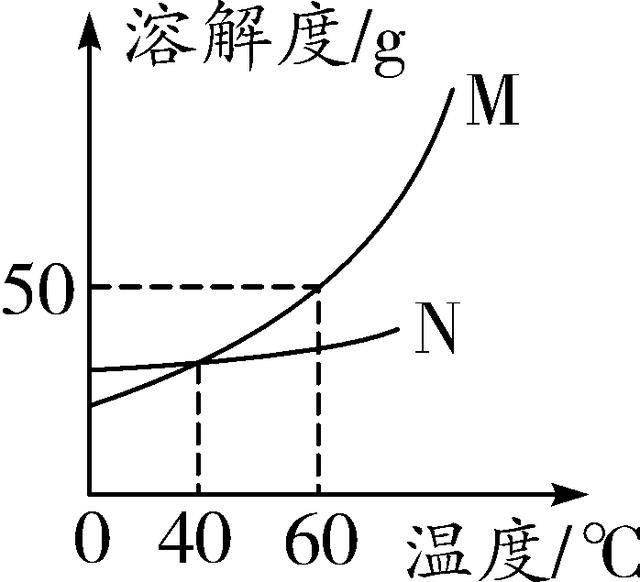
第8题图
A. M物质的溶解度受温度影响变化较大
B. 40 ℃时,M、N两种物质的溶解度相等
C. 升高温度可将M的饱和溶液变为不饱和溶液
D. 60 ℃时,饱和溶液中溶质的质量分数大小关系为N>M
9. (2016安徽十校联考四)如图是甲、乙两种固体物质的溶解度曲线。下列说法错误的是( )
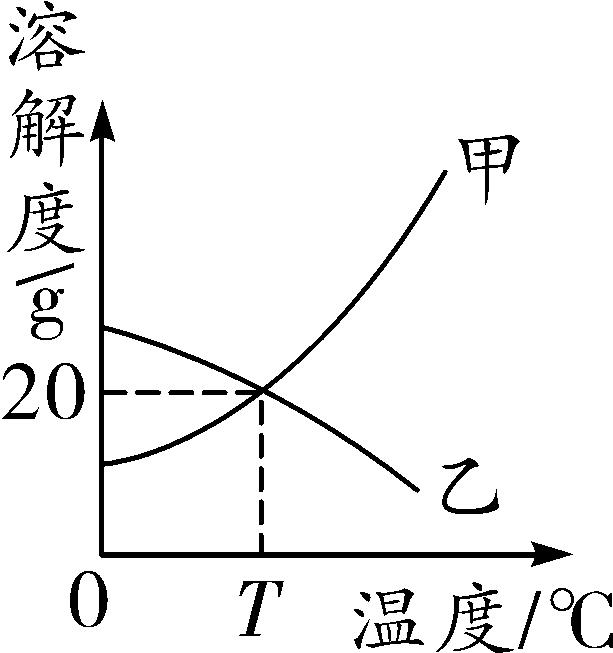
第9题图
A. T ℃时,甲、乙两物质的溶解度相等
B. 乙的饱和溶液降温时,溶质质量分数保持不变
C. 甲中混有少量乙,可采用降温结晶的方法提纯甲
D. T ℃时,甲的饱和溶液溶质质量分数为20%
10. (2016无锡)NaCl、KNO3两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A. 20℃时,NaCl的溶解度为31.6 g
B. KNO3的溶解度大于NaCl的溶解度
C. 使NaCl从其饱和溶液中析出,可采用蒸发溶剂的方法
D. 50 ℃时,在100 g水中加入100 g KNO3,所得溶液中KNO3的质量分数为50%
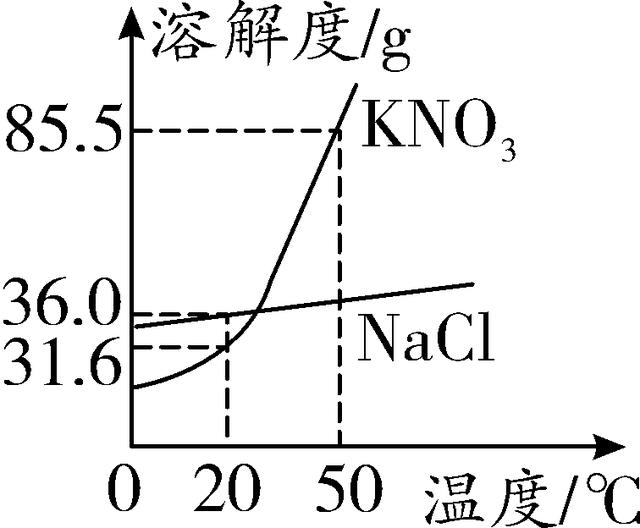
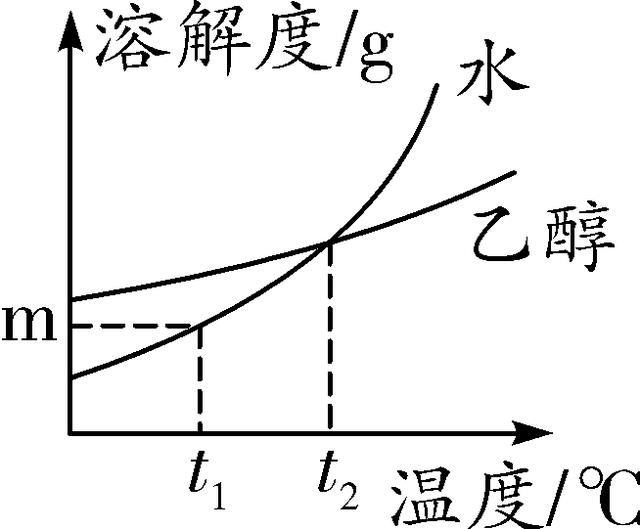
第10题图 第11题图
11. (2016阜阳二模)固体物质W在水、乙醇两种溶剂中的溶解度随温度变化的曲线如图所示。下列说法正确的是( )
A. 物质W在水中的溶解度小于其在乙醇中的溶解度
B. t2 ℃时,物质W溶解在水中和乙醇中的溶质质量分数一定相等
C. t1 ℃时,m g W分别溶解在100 g水和乙醇中,两者都达到了饱和状态
D. 将t1 ℃时物质W的饱和乙醇溶液升温至t2 ℃,溶质质量分数不变
12. (2016连云港)甲、乙两种物质的溶解度曲线如图所示。下列说法正确的是( )
A. a1℃时甲的饱和溶液,升温至a2℃时仍是饱和溶液
B. 乙的溶解度随温度的升高而增大
C. 相同温度时,甲的溶解度一定大于乙的溶解度
D. 分别将甲、乙的饱和溶液从a2℃降至a1℃时,所得溶液中溶质的质量分数相等
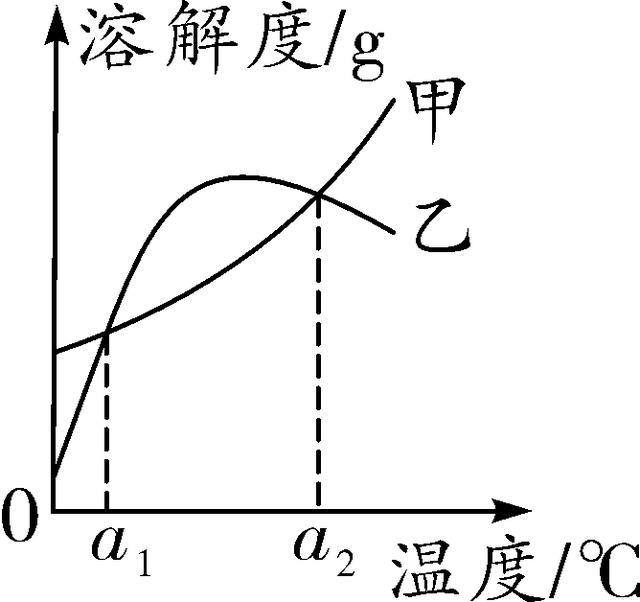
第12题图 第13题图
eq \\x(类型四) 三条溶解度曲线
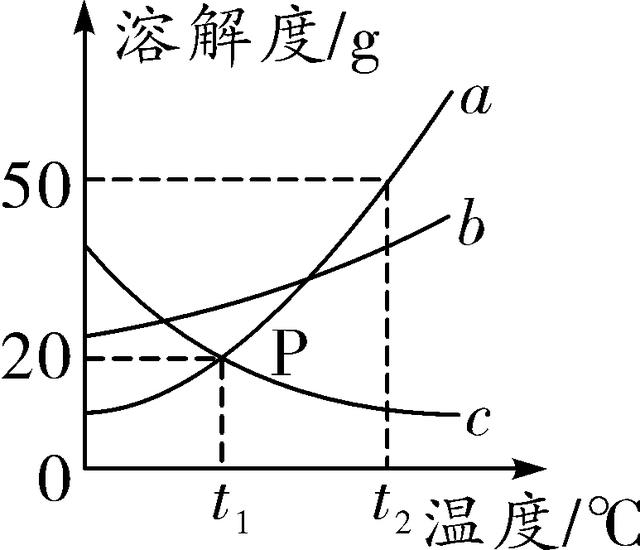
13. (2016常德)三种固体物质a、b、c的溶解度曲线如图所示,则以下说法不正确的是( )
A. t1℃时三种物质的饱和溶液中溶质的质量分数大小为b>a=c
B. a、b、c三种物质的饱和溶液从t2℃降温到t1℃时都有晶体析出
C. t2℃时,将50 g a物质加入到100 g水中完全溶解形成饱和溶液
D. a中混有少量b时可采取降温结晶的方法提纯得到a
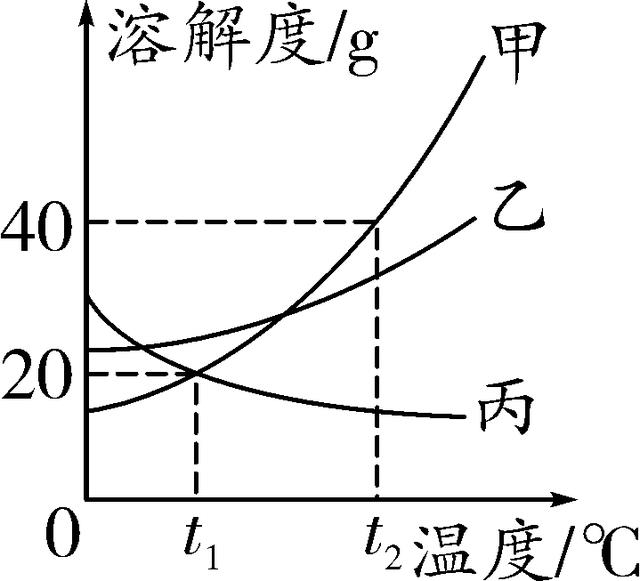
14. (2016黔东南州)如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法中正确的是( )
A. 甲、乙、丙三种物质的溶解度都随温度升高而增大
B. t1°C时,丙物质的饱和溶液中溶质质量分数为20%
C. t2°C时,将50 g甲物质放入100 g水中,充分搅拌,所得溶液的总质量为150 g
D. 将t1°C时甲、丙两种物质的饱和溶液升温至t2°C,溶质质量分数不变的是甲溶液
第14题图 第15题图
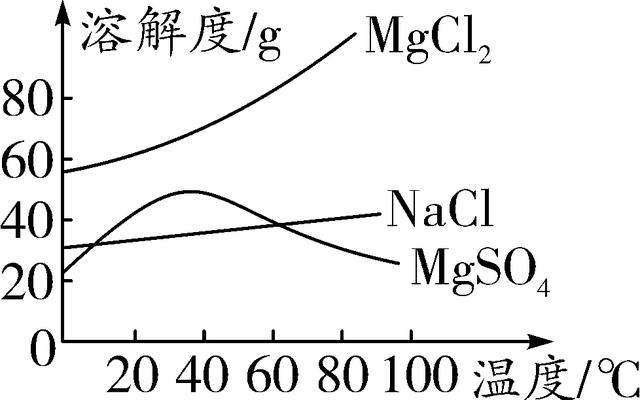
15. (2016德阳)海水晒盐提取食盐晶体后留下的母液叫卤水,卤水中除含NaCl外,还含有MgCl2、MgSO4等物质。它们的溶解度曲线如图所示。下列说法中正确的是( )
A. 0 ℃时,三种物质的饱和溶液中,溶质质量分数最大的是MgSO4
B. 三种物质的溶解度都随温度升高而不断增大
C. 将卤水加热到80 ℃以上蒸发水分,逐渐析出的晶体是NaCl和MgSO4
D. 20 ℃时,向40 g NaCl固体和40 g MgCl2固体分别加入100 g水充分溶解后,两种溶液均能达到饱和状态
eq \\x(类型五) 溶解度曲线结合实物图
16. A、B两种物质的溶解度曲线如图甲所示,在t2℃时,A、B两种物质配制溶液的情况如图乙所示,下列说法正确的是( )
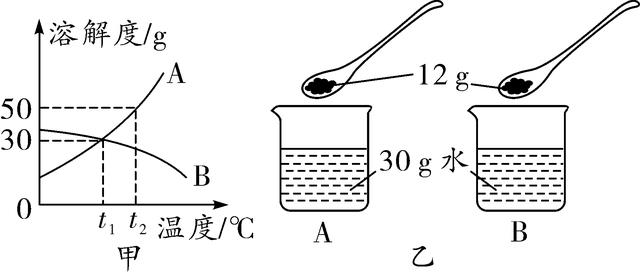
第16题图
A. t1℃时,两个烧杯内均有固体剩余,且质量相等
B. 由t1℃到t2℃过程中,A溶液中溶质的质量分数减小
C. t2℃时,烧杯中的A溶液为饱和溶液
D. 由t2℃到t1℃,B的溶液中有晶体析出
1.B【解析】

2. B 【解析】由表中数据可知,20℃时氯化钾的溶解度大于硝酸钾的溶解度,A正确;由于40℃时氯化钾的溶解度为40.0 g,该温度下10 g水中最多溶解4.0 g氯化钾,将5 g氯化钾加入10 g水中,不能全部溶解,所得溶液的溶质质量分数为eq \\f(4 g,14 g)×100%≈28.6%<33.3%,B错误;由于20 ℃时氯化钾的溶解度大于硝酸钾的溶解度,30 ℃时硝酸钾的溶解度大于氯化钾的溶解度,所以氯化钾和硝酸钾溶解度相等的温度应该在20~30 ℃之间,C正确;30 ℃时硝酸钾的溶解度为45.8 g,在该温度下20 g水中最多溶解硝酸钾9.16 g,所以该温度下将10 g硝酸钾加入20 g水中,硝酸钾不能全溶解,D正确。
3. D 【解析】由曲线图可知,KNO3的溶解度随温度的升高而增大,当降低温度,可以使接近饱和的硝酸钾溶液变成饱和溶液,A、B正确;60 ℃时,KNO3的溶解度小于120 g,故当120 g硝酸钾与100 g水充分混合后,可以形成饱和溶液,C正确;未明确60℃时和30℃时两种硝酸钾溶液是否饱和,所以不能确定其溶液的溶质质量分数的大小,D错误。
4. B 【解析】图中斜线上的点表示t ℃时不同质量的水中达到饱和状态时所溶解的溶质的质量,由图可知,该温度下100 g水中达到饱和状态时能溶解40 g该溶质,所以在该温度下该溶质的溶解度为40 g,要带单位,A错误;P、Q两点都在斜线上,即这两点对应的溶液都是t ℃时的饱和溶液,所以两点对应溶液的溶质质量分数相等,B正确;N点表示100 g水中溶解有20 g该物质,此时溶液中溶质的质量分数为eq \\f(20 g,120 g)×100%≈16.7%,C错误;溶解度的大小与温度有关,与溶剂的质量无关,D错误。
5. D 【解析】根据溶解度曲线图可知,20 ℃,甲物质的溶解度小于0.2 g,属于微溶物质,A错误;60 ℃时甲的溶解度约为0.6 g,B错误;甲物质的溶解度随温度升高而增大,但是没有说明80 ℃时甲溶液的溶质质量分数或溶质、溶剂质量,不能确定降温至40 ℃时一定析出晶体,C错误;90 ℃时,甲物质的溶解度是1.3 g,此时在50 g水中加入0.7 g甲,只能溶解0.65 g,得到饱和溶液,D正确。
6. C 【解析】A选项中未提到溶液状态,无法计算溶质质量分数;B选项中40 ℃时溶解度最大,此时的饱和溶液升高温度溶解度减小,溶液仍为饱和溶液;D选项中50 ℃饱和溶液升温至80 ℃,溶解度减小,溶液仍为饱和溶液;C选项中40 ℃饱和溶液降温至10 ℃,溶解度减小,饱和溶液中有固体析出,故选C。
7. B 【解析】由图可知,t1 ℃时两种物质的溶解度曲线有一个交点,所以没有指明温度时,无法比较两者溶解度的大小,A错误;由图可知,甲和乙的溶解度曲线都是上升型的,说明两种物质的溶解度都随温度升高而增大,B正确;t1℃时甲和乙的溶解度曲线相交,说明该温度下甲和乙的溶解度相等,两种物质饱和溶液的溶质质量分数相等,但对不饱和溶液,则无法比较其溶液中溶质质量分数的大小,C错误;t2℃时甲的溶解度为50 g,即该温度下,100 g水中溶解50 g甲,恰好达到饱和状态,此时溶液的溶质质量分数为eq \\f(50 g,50 g+100 g)×100%≈33.3%,D错误。
8. D 【解析】根据溶解度曲线图可知,M的溶解度曲线比较陡峭,说明M的溶解度受温度影响变化较大,A正确;40℃时,M、N溶解度曲线交于一点,说明该温度时,两种物质的溶解度相等,B正确;M的溶解度随温度的升高而增大,因此升高温度可将M的饱和溶液变为不饱和溶液,C正确;60 ℃,M的溶解度大于N的溶解度,根据公式:饱和溶液的溶质质量分数=eq \\f(S,100 g+S)×100%可知,60 ℃时,M、N两种饱和溶液中溶质的质量分数大小关系为M>N,D错误。
9. D 【解析】T ℃甲和乙的溶解度曲线相交,说明此温度下,甲和乙的溶解度相等,A正确;乙的溶解度随温度升高而减小,所以将乙的饱和溶液降温,由于溶解度增大,溶液由饱和变成不饱和,溶液的溶质质量分数保持不变,B正确;甲的溶解度随温度升高而增大,乙的溶解度随温度升高而减少,所以甲中混有少量乙,可采用降温结晶的方法提纯甲,C正确;T ℃甲的溶解度为20 g,该温度下甲的饱和溶液的溶质质量分数为eq \\f(20 g,20 g+100 g)×100%≈16.7%,D错误。
10. C 【解析】20 ℃时氯化钠的溶解度为36.0 g,硝酸钾的溶解度为31.6 g,A错误;20 ℃时硝酸钾的溶解度小于氯化钠的溶解度,B错误;由于氯化钠的溶解度受温度变化影响较小,常用蒸发溶剂的方法可使氯化钠从其饱和溶液中结晶析出,C正确;50 ℃时硝酸钾的溶解度为85.5 g,所以该温度下100 g水中加入100 g硝酸钾,硝酸钾不能完全溶解,所得溶液的溶质质量分数小于50%,D错误。
11. D 【解析】固体W在水中的溶解度曲线与在乙醇中的溶解度曲线温度为t2℃时相交,但未指明温度时,无法比较W在水中和在乙醇中的溶解度大小,A错误;t2℃时W在水中的溶解度曲线与在乙醇中的溶解度曲线相交,说明该温度下W在水中和在乙醇中的溶解度相等,该温度下W在水中和在乙醇中形成的饱和溶液的溶质质量分数相等,但对不饱和溶液则不能比较它们的溶质质量分数,B错误;t1℃时W在水中的溶解度为m g,而该温度下W在乙醇中的溶解度大于m g,所以该温度下分别将m g W分别溶解在100 g水和乙醇中,溶解在乙醇中得到不饱和溶液,溶解在水中恰好形成饱和溶液,C错误;由于W在乙醇中的溶解度随温度升高而增大,所以将W的饱和乙醇溶液升温时,溶液变成不饱和溶液,溶质质量分数不变,D正确。
12. D 【解析】依据甲的溶解度曲线可推出,甲的溶解度随温度的升高而增大,因此,a1 ℃时甲的饱和溶液,升温至a2 ℃时则变为不饱和溶液;依据乙的溶解度曲线可推出,乙的溶解度先随着温度的升高而增大,后又随着温度的升高而减小;因为甲、乙的溶解度曲线有两个交点,在交点所对应温度下,甲、乙的溶解度相等;一定温度下,饱和溶液的溶质质量分数=eq \\f(溶解度,溶解度+100 g)×100%,可推出分别将甲、乙的饱和溶液从a2 ℃降至a1 ℃时,所得溶液中溶质的质量分数相等;故选D。
13. B 【解析】t1℃时三种物质溶解度曲线上纵坐标最大的是b,a和c的溶解度曲线相交于P点,该温度下两种物质的溶解度相等,A正确;a、b两种物质的溶解度随温度升高而增大,所以这两种物质的饱和溶液降温时会析出晶体,但c的溶解度随温度升高而减小,其饱和溶液降温时变成不饱和溶液,没有晶体析出,B错误;t2 ℃时a的溶解度为50 g,所以该温度下将50 g a加入100 g水中完全溶解恰好形成饱和溶液,C正确;a的溶解度受温度影响较大,b的溶解度受温度影响较小,所以a中混有少量的b时,可采取降温结晶的方法提纯a,D正确。
14. D 【解析】由甲、乙、丙三种固体物质的溶解度曲线知,甲、乙两种物质的溶解度随温度的升高而增大,丙物质的溶解度随温度的升高而减小,A错误; t1 ℃时,丙物质的溶解度为20 g,即将20 g的丙物质溶于100 g水中就得到该温度下的饱和溶液,则在该温度下丙物质的饱和溶液中溶质的质量分数为eq \\f(20 g,20 g+100 g)×100%≈16.7%,B错误;t2 ℃时,甲物质的溶解度是40 g,则在该温度下,100 g的水中最多可溶解40 g甲,即可物质形成饱和溶液,因此t2 ℃时,将50 g甲物质放入100 g水中,充分搅拌,所得溶液的总质量为140 g,C错误;故选D。
15. C 【解析】饱和溶液的溶质质量分数=eq \\f(溶解度,溶解度+100 g)×100%,所以溶解度越大,饱和溶液溶质质量分数越大,0 ℃时,MgCl2的溶解度最大,所以MgCl2饱和溶液的溶质质量分数最大,A错误;由曲线图可知,随着温度的增大,MgSO4的溶解度先增大,后减小,B错误;80 ℃时,MgCl2的溶解度远远大于NaCl和MgSO4,此温度下蒸发溶剂,溶解度小的物质先析出来,C正确;20 ℃时,MgCl2的溶解度大于40 g,NaCl的溶解度小于40 g,即100 g水中可溶解MgCl2的质量大于40 g,那么100 g水溶解40 g MgCl2未达到饱和状态,而100 g水溶解40 g NaCl可达到饱和状态,D错误。
16. A 【解析】根据溶解度曲线可知t1℃时,A、B的溶解度相等都是30 g,即100 g水中最多溶解30 g A或B,30 g水中最多溶解9 g A或B,乙图向30 g水中总共加入了12 g A、B,不能完全溶解,A正确;由t1℃升温到t2℃时,A的溶解度增大,原来未溶解的A继续溶解,溶质质量分数增大,B错误;t2℃时,A的溶解度是50 g,30 g水中最多溶解15 g A,则烧杯中得到的是A的不饱和溶液,C错误;B的溶解度随着温度的升高而减小,由t2℃到t1℃,B的溶解度增大,不会有晶体析出,D错误。
相关参考