溶解度s和ksp关系式(第8章 微题型74 难溶电解质溶度积常数及图像 2022年新高考化学)
Posted
篇首语:古人学问无遗力,少壮工夫老始成。本文由小常识网(cha138.com)小编为大家整理,主要介绍了溶解度s和ksp关系式(第8章 微题型74 难溶电解质溶度积常数及图像 2022年新高考化学)相关的知识,希望对你有一定的参考价值。
溶解度s和ksp关系式(第8章 微题型74 难溶电解质溶度积常数及图像 2022年新高考化学)

1.(2020·陕西新城西安中学高三月考)已知:pAg=-lg c(Ag+),pX=-lg c(Xn-)。298 K时,几种物质的Ksp的值如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×10-10 | 1.0×10-12 | 2.0×10-12 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是( )

A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298 K时,在Cl-和CrO的物质的量浓度均为0.1 mol·L-1的溶液中,滴入少量0.1 mol·L-1的AgNO3溶液,首先产生的是红色沉淀
C.298 K时,若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298 K时,Ag2CrO4(s)+2SCN-(aq)2AgSCN(s)+CrO(aq)的平衡常数K=2.0×1012
2.(2020·江苏高三调研)下列有关实验原理、方法和结论都正确的是( )
A.已知Cu2O+2H+===Cu2++Cu+H2O,氢气还原氧化铜后所得红色固体能完全溶于稀硝酸,说明还原产物是铜
B.取一定量水垢加盐酸,生成能使澄清石灰水变浑浊的气体,说明水垢的主要成分为CaCO3、MgCO3
C.向5 mL 0.1 mol·L-1KI溶液中加入0.1 mol·L-1的FeCl3溶液1 mL,振荡,用苯萃取2~3次后取下层溶液滴加5滴KSCN溶液,出现红色,说明反应2Fe3++2I-===2Fe2++I2是有一定限度的
D.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4)
3.常温下,Fe(OH)3和Cu(OH)2沉淀溶解平衡曲线如图所示。下列有关说法正确的是( )

A.Ksp[Fe(OH)3]>Ksp[Cu(OH)2]
B.a、b、c、d四点的Kw不同
C.在Fe(OH)3饱和溶液中加入适量硝酸钾晶体可使a点变到b点
D.d点时的Cu(OH)2溶液为不饱和溶液
4.一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。已知:pM=-lg c(M),p(CO)=-lg c(CO)。下列说法正确的是( )
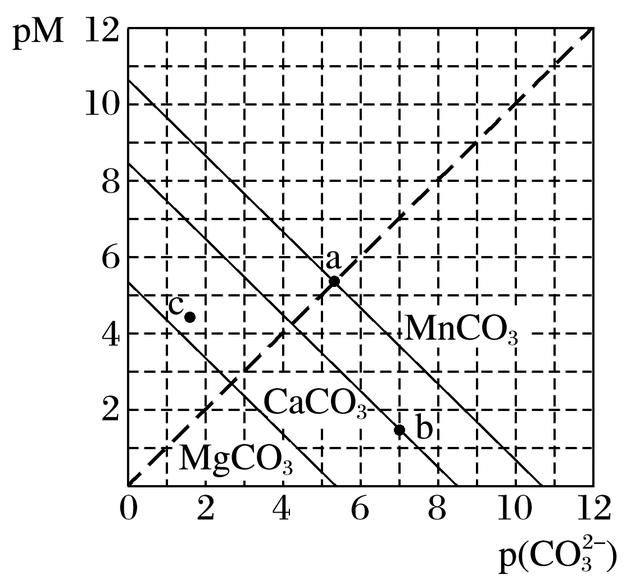
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+) <c(CO)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO)
D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO)
5.(2020·赤峰二中高三月考)25 ℃时,PbR(R2-为SO或CO)的沉淀溶解平衡关系图如图所示。已知Ksp(PbCO3)<Ksp(PbSO4),下列说法不正确的是( )

A.线a表示PbCO3
B.Y点溶液是PbCO3 的过饱和溶液
C.当PbSO4和PbCO3沉淀共存时,溶液中c(SO)和c(CO)的比是1×105
D.向X点对应的饱和溶液中加入少量Pb(NO3)2,可转化为Y点对应的溶液
6.(2021·济南高三模拟)常温下,将11.65 g BaSO4粉末置于盛有250 mL蒸馏水的烧杯中,然后向烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中不正确的是( )

A.相同温度时,Ksp(BaSO4)<Ksp(BaCO3)
B.若使0.05 mol BaSO4全部转化为BaCO3,至少加入1.3 mol Na2CO3
C.BaSO4恰好全部转化为BaCO3时,溶液中离子浓度大小为c(CO)>c(SO)>c(OH-)>c(Ba2+)
D.BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大
7.某温度时硫酸盐MSO4(M:Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知p(M)=-lg c(M),p(SO)=-lg c(SO)。下列说法正确的是( )
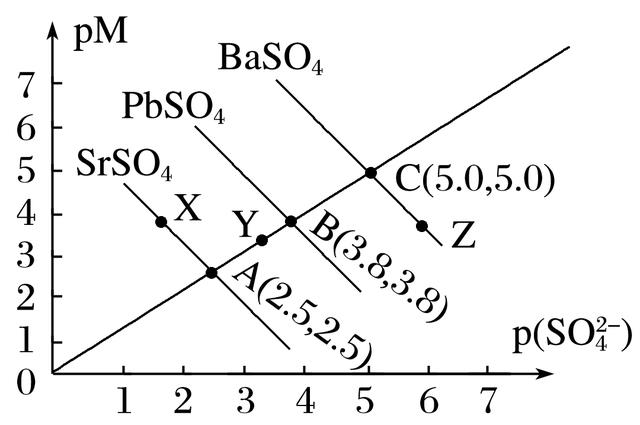
A.向BaSO4悬浊液中加入浓度较大的Pb(NO3)2溶液可能转化成PbSO4
B.X、Y两点对应的SrSO4均是饱和溶液,不能继续溶解SrSO4
C.蒸发Z点的BaSO4溶液可得到C点状态的BaSO4溶液
D.溶度积:Ksp(SrSO4)<Ksp(PbSO4)<Ksp(BaSO4)
8.(2020·开鲁县第一中学高三月考)已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO B.CrO、Br-、Cl-
C.Br-、Cl-、CrO D.Br-、CrO、Cl-
9.(2020·江西东湖南昌二中高三月考)某温度下,向50 mL CuCl悬浊溶液中缓慢加入NaI固体并搅拌,溶液中c(I-)与c(Cu+)的变化曲线如图所示,已知:Ksp(CuI)=1.0×10-12,下列说法正确的是( )

A.Ksp(CuCl)=1.0×10-9
B.图示中的x为10-6
C.向CuI饱和溶液中加入淀粉会出现蓝色
D.曲线bc段内,c(Cl-)∶c(I-)=106
10.(2020·广州高三月考)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应 Ⅰ:WO(aq)+Ca(OH)2(s)CaWO4(s)+2OH-(aq)。
(1)如图为不同温度下Ca(OH)2、CaWO4 的沉淀溶解平衡曲线。
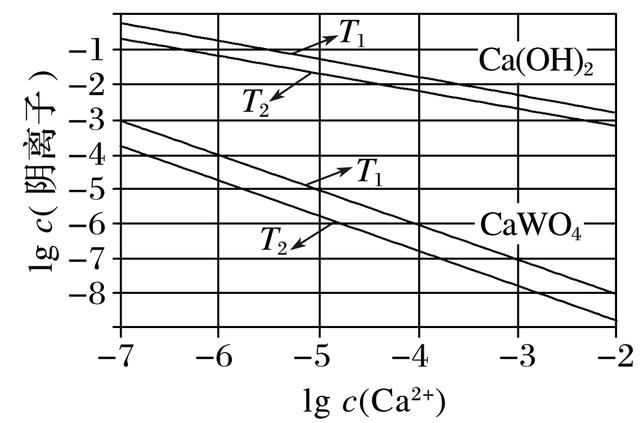
①计算T1时,Ksp(CaWO4)=____________________。
②T1________T2(填“>”“=”或“<”)。
(2)反应Ⅰ的平衡常数K理论值如表:
温度/℃ | 25 | 50 | 90 | 100 |
K | 79.96 | 208.06 | 222.88 | 258.05 |
①该反应平衡常数K的表达式为________________。
②该反应的ΔH__________0(填“>”“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50 ℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5 mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后WO的沉淀率为60%,此时WO的平衡浓度为__________mol·L-1,实验测得的平衡常数为________(保留小数点后两位)。
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,其作用是________________________________________________________________________
________________________________________________________________________。
11.(2020·临朐县实验中学高三月考)铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:

Ⅰ.铍、铝元素的化学性质相似,单质铍与氢氧化钠溶液反应生成可溶于水的Na2BeO2。
Ⅱ.常温下部分难溶物的溶度积常数如表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH外,还有__________(填化学式),写出反应Ⅰ中含铍化合物与过量盐酸反应的离子方程式:___________________________________________________。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序__________。
a.加入过量氨水 b.通入过量CO2 c.加入过量NaOH
d.加入适量HCl e.洗涤 f.过滤
②从BeCl2溶液中得到BeCl2固体的操作是___________________________________________
_______________________________________________________________________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:________________________________________________________________________
______________________________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是________________________(任写一条)。
(4)滤液D中c(Cu2+)=2.2 mol·L-1、c(Fe3+)=0.008 mol·L-1、c(Mn2+)=0.01 mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,为使铜离子开始沉淀,常温下应调节溶液的pH大于____________。
相关参考
氢氧化(第3章 微题型23 氢氧化亚铁、高铁酸钾制备实验探究 2022年新高考)
...的性质。绝对不溶的电解质是没有的。同是难溶电解质,溶解度差别也很大。影响沉淀溶解平衡的外因:浓度、温度、同离子效应。03溶度积规
...的性质。绝对不溶的电解质是没有的。同是难溶电解质,溶解度差别也很大。影响沉淀溶解平衡的外因:浓度、温度、同离子效应。03溶度积规
焙烧碳酸锰制取二氧化锰(高三学生最怕的化工流程题——经典必做题型(精选))
化学《工艺流程》专题训练1.我国是干电池的生产和消费大国。某科研团队设计了以下流程对碱性锌锰干电池的废旧资源进行回收利用:已知:①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8⑴...
焙烧碳酸锰制取二氧化锰(高三学生最怕的化工流程题——经典必做题型(精选))
化学《工艺流程》专题训练1.我国是干电池的生产和消费大国。某科研团队设计了以下流程对碱性锌锰干电池的废旧资源进行回收利用:已知:①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8⑴...
影响气体溶解度大小的因素(初中化学溶解度曲线考点,中考必考题型,尖子生的学习策略)
下划线内容为高频考点一、饱和溶液和不饱和溶液1.饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液。不饱和溶液:在一定温度下,向一定量溶剂里加入...
溶解度随温度变化不大的物质(初中化学溶解度曲线考点,中考必考题型,尖子生的学习策略)
下划线内容为高频考点一、饱和溶液和不饱和溶液1.饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液。不饱和溶液:在一定温度下,向一定量溶剂里加入...
溶解度随温度变化不大的物质(初中化学溶解度曲线考点,中考必考题型,尖子生的学习策略)
下划线内容为高频考点一、饱和溶液和不饱和溶液1.饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液。不饱和溶液:在一定温度下,向一定量溶剂里加入...
1、根据溶解度的大小和作物吸收的难易,通常将磷肥划分为水溶性磷肥、弱酸溶性磷肥和难溶性磷肥三大类。2、凡能溶于水(指其中含磷成分)的磷肥,称为水溶性磷肥,如过磷酸钙、重过磷酸钙;凡能溶于2%柠檬酸或中性柠...
沉淀溶解条件(高中化学重难点讲解—利用溶度积来判断沉淀的生成和溶解)
在Pb2+浓度为1.5×10-2mol/L的溶液20mL中,加入1mol/LNaCl溶液20mL,有没有PbCl2沉淀析出?[Pb2+][Cl-]2=(7.5×10-3)(0.5)2=7.5×10-3×0.25=1.9×10-3PbCl2的KSP=1.6×10-5,现在[Pb2+][Cl-]2>KSP,所以有PbCl2沉淀析出。