沉淀溶解条件有哪些(化学反应中产生的沉淀就一定不会分解成反应物吗?)
Posted
篇首语:走路不怕上高山,撑船不怕过险滩。本文由小常识网(cha138.com)小编为大家整理,主要介绍了沉淀溶解条件有哪些(化学反应中产生的沉淀就一定不会分解成反应物吗?)相关的知识,希望对你有一定的参考价值。
沉淀溶解条件有哪些(化学反应中产生的沉淀就一定不会分解成反应物吗?)
颤抖吧化学
在我们的学习印象中,好像可逆反应中不会有沉淀的产生,产生沉淀的化学反应也没有见过可逆的情况,然而事情是我们所见的这样吗?
其实学习到后面我们就会发现,基本上每个化学反应都或多或少的发生着可逆的过程,那让我们一起来看一下究竟是什么情况。

首先看一下,物质的溶解度我们在化学中是怎么来定义的(化学家设置的规则啊)
1.物质的溶解性
电解质在水中的溶解度,有的很大,有的很小,但仍有度。在20℃时溶解性与溶解度的关系如下:
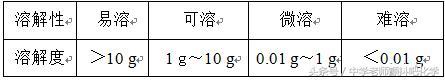
说明:物质在水中“溶”与“不溶”是相对的,“不溶”是指难溶,没有绝对不溶的物质。
2.难溶物的溶解平衡
难溶电解质的离子进入溶液的速率和从溶液里转回到电解质固体表面沉积的速率相等,溶液里的离子处于饱和及固态电解质的量保持不变的状态,叫做难溶电解质的沉淀溶解平衡状态,简称沉淀溶解平衡。

所以,就有一个溶度积的概念:
3.沉淀溶解平衡常数——溶度积。
(1)定义:在一定条件下,难溶强电解质AmBn溶于水形成饱和溶液时,溶质的离子与该固态物质之间建立动态平衡,叫做沉淀溶解平衡。这时,离子浓度幂的乘积为一常数,叫做溶度积Ksp。
表达式
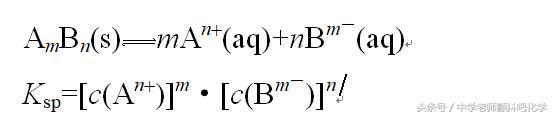
溶度积(Ksp)的大小只与难溶电解质的性质和温度有关,与浓度无关!
(3)溶度积规则:
通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积Qc的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解;
Qc>Ksp,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡;
Qc=Ksp,溶液饱和,沉淀与溶解处于平衡状态;
Qc<Ksp,溶液未饱和,无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。
喜欢Darren老师的点击关注吧!

相关参考