水石灰石纯碱制取烧碱(生存篇:战略储备物资---【 碱 】的重要性与制备方法)
Posted
篇首语:从来好事天生俭,自古瓜儿苦后甜。本文由小常识网(cha138.com)小编为大家整理,主要介绍了水石灰石纯碱制取烧碱(生存篇:战略储备物资---【 碱 】的重要性与制备方法)相关的知识,希望对你有一定的参考价值。
水石灰石纯碱制取烧碱(生存篇:战略储备物资---【 碱 】的重要性与制备方法)
喜欢极限生存的朋友,烦请关注本头条号「生存世嘉」,同公众号「生存世嘉」
三酸两碱,是化工行业的基础。各位极限生存者能够制得它们,就标志着建立化学工业的里程碑。

如果可以知道怎么制碱,那么在战乱中和战乱后,都是非常牛掰的技能。
这里的酸,是指的硫酸、盐酸、硝酸;碱是指的纯碱与烧碱。
日化产品和药品中,用到碱的地方很多。这是现在日常家里用的都越来越有针对性了。之前做饭用纯碱,小苏打。洗碗,洗衣服都用纯碱。通下水道用火碱。现在都用酵母粉,泡打粉,洗洁精,洗衣粉,洗衣皂,洗衣液,疏通剂等等了。这些产品生产过程中,或者配方里都有碱。
纯碱,又称苏打,化学名:碳酸钠,化学式:Na2CO3。是一种应用非常广的基本化学物质,常见的化工原料。

老百姓们常用纯碱加到热水中,清洗油污。其本质是使油脂在碱性条件下水解。
还可以当作“馒头改良剂”。因为发酵后的面会产生酸味,加少量的纯碱,可以中和掉微生物发酵产生的酸。也可以加入一点纯碱的兄弟——小苏打(NaHCO3),制出的馒头更加蓬松。

请注意,苏打和小苏打的作用是不一样的哦!前者是中和,后者是发泡。例如,做油条的时候加入的就应该是小苏打(碳酸氢钠)。

化学制碱可以说是一件非常繁琐的事情。在这一期中,我们就来说说在那个合成氨还没有出现的年代,人类是如何制备纯碱也就是碳酸钠的。
现代无机化工最重要的几个产品包括三酸两碱(硫酸,硝酸,盐酸,纯碱,烧碱)再加上合成氨。但是非常有意思的是,除了合成氨以外,剩下的产品在工业革命以前似乎都不是我们生活中的必须品。
想象一下,中国古代文明,从几千年前开始萌芽发展到鸦片战争以前,对于三酸两碱的需求都非常小。当然合成氨是个例外,如果有合成氨的话,中国古代就能很大程度上避免因为人口与粮食问题导致的周期性社会动荡。
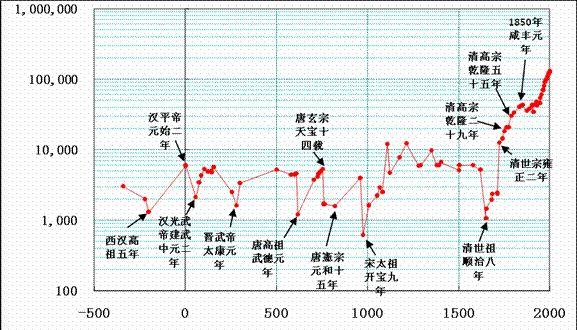
中国各时期的人口数量变化呈现明显的周期性,这是因为土地能承载的人口是有限的,当人口过多的时候就会因为粮食不足导致社会动荡,使人口减少。从这一点上看我们与培养皿里的细菌没有什么区别。至于在16世纪以后中国人口爆发性提高,这主要是由于新大陆的发现导致一系列优势粮食作物被引进。
再说到纯碱,所谓需求决定生产,但是在古代,人们对纯碱的需求还真不高。在那个时候,纯碱是被作为食品添加剂使用的。我们知道,由于酵母的呼吸作用,如果在发面的过程中不添加纯碱的,发出来的面会有一股酸味,进而影响口感。但是说实话,有的吃就不错了,口感完全是次要的。这个时期纯碱不是必须品,人类对纯碱的消耗是非常少的。这就导致了在相当长的一段时间内,即使是采用低效率的方式生产纯碱,这个产量仍然能够保证人类的需求。

中国南方一般以米饭为主食,对碱需求小,在北方虽然以小麦为主,但馒头与面条对于普通百姓来说一直都是奢侈品。而欧洲一度以土豆作为主粮,白面包这类的东西也是高档货,大部分人吃的起的还是这种黑面包(面粉里掺了麸子),这个就没有加碱,有一股特殊的酸味。
在古代这种低效生产纯碱的方法就是所谓的植物提取。在植物体内一般都含有一定量的碳酸钾与碳酸钠。古人将植物晒干,烧成灰形成草木灰。之后将草木灰装进布袋里,然后用水淋洗就能得到碱液,这里的碱液主要含有碳酸钠与碳酸钾。这个工艺可以说是靠山吃山靠水吃水,基本上所有的草本植物都可以作为原料。田边的杂草到处都是,根本不缺,从某种意义上来说,古人想要吃馒头,缺的从来都不是碱,而是面。

此外盐碱湖也是纯碱重要的来源,由于碳酸钠溶解度随着温度降低而降低,氯化钠溶解度几乎不随温度变化,所以在盐湖里,冬天天气一冷下来,就会在岸边结晶出纯碱是天然的纯碱来源。
长期以来,天然来源的纯碱完全可以满足人类需要,但是这一切在工业革命开始以后就发生了改变。首先是工业革命以后粮食的生产能力大大提高,世界人口大量增长,纯碱在食品中的需求量加大。另外,工业革命带动了一系列的下游产业的迅猛发展,从纺织业到玻璃加工再到造纸行业,各个行业都需要纯碱。这时候天然纯碱的产量就非常难看了,在这种情况下,化学合成纯碱的工作开始逐步开展起来。
最早由记载的化学合成纯碱的路线在1737年(乾隆二年),这个研究只是实验性质,并没有实现工业化。主要还是这个时代恰好是工业革命的黎明时期,对纯碱的需求还不是特别大。但是随后由瑞典化学家舍勒(1773年,纪晓岚开始编四库全书)与法国化学家马勒比(1777年)开发出的两个工艺路线均实现了工业化生产。而这个时候,正是工业革命开始发展的阶段,对于纯碱的需求迅速增加。
但这二位的两条路线都是非常繁琐的,与我们今天见到的路线不同,这也是没有办法的,因为当时化工行业发展非常落后很多今天常见的化工原料比如氨气与烧碱的制备都非常困难。
另外值得注意的是,这两个路线均选择了NaCl作为起始原料,这不是巧合,这与当时化学的发展有关。十八世纪中叶正是拉瓦锡(1743-1794)活跃的时代,拉瓦锡的一大贡献就是采用计量分析的方法对化合物进行分析。在这种研究思路的指导下,当时化学家已经知道食盐与纯碱中含有一种“公共的成分”,因此必然纯碱的合成要采用NaCl为原料,后续的所有工艺也都跳不开这一点。现在我们知道这个成分就是Na,不过当时的化学家并不知道这一点,Na的发现者戴维(1778-1829)这时候刚刚出生。
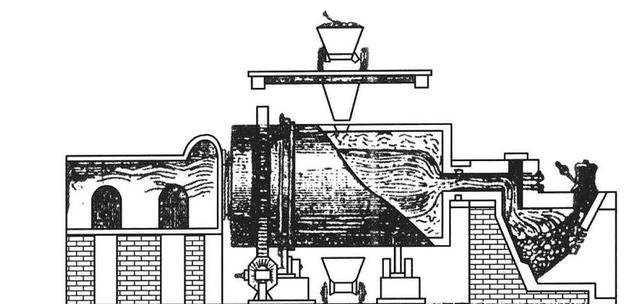
到了后期,马勒比工艺中的硫酸钠与木炭还有氧化铁的共热就由回转窑完成了,最早的回转窑出现于1785年,也就是马勒比工艺出现6年后,虽然最初是用于水泥行业的,但后来很快就被纯碱行业消化利用,后来的路布兰工艺也采用了类似设备。
此后制纯碱的工艺还进行了一系列改进,比较出名的就是路布兰工艺。该工艺分为3步:
第一步还是NaCl与硫酸作用生成硫酸钠。关键的改进发生在第二步中:硫酸钠与石灰石,木炭放入回转窑内加热,在一系列的反应过程可以生成纯碱与硫化钙。反应的产物是一种黑色的物质,这种物质被称为黑灰。随后将这种黑灰用水浸泡,由于硫化钙与未反应的木炭不溶于水,因此可以得到纯碱溶液。

路布兰的一生也可以说是非常悲剧的,他原本是一个医生,而且是为奥尔良公爵服务的私人医生。1783年,法国国王路易十六发布了悬赏令,征集改良纯碱生产工艺的方法。路布兰在奥尔良公爵的资助下开始研究,并最终于1789取得成功。可是这个时候偏偏赶上法国大革命,给他发奖金的路易十六直接被送上断头台咔嚓了,也就没人给他发奖金了。路布兰在奥尔良公爵的支持下,将该工艺于1791年投入生产,他也过了几天日进斗金的生活。可是好景不长,1793年奥尔良公爵不知道怎么的也得罪了革命党,随后他也被送上断头台咔嚓了。路布兰的工厂也被没收。最后贫病交加的他在1806(嘉庆11年)年自杀身亡。
可以看到,传统的制碱工艺无论如何发展都是非常繁琐的,同时反应过程中产生了大量的副产物。这些反应都经历过了一个固相共热的过程,这种过程往往转化率不如液相反应高。因此需要进一步改进。早期的制碱工艺都没有把氨当作原料,这是因为当时工艺限制,大规模制备氨气还是难以完成的任务。但是路布兰制碱法没有风光多久,随着制氨工业的发展,氨碱法很快出现,并最终登上了历史舞台。关于氨碱法的发展历史,

各位生存者不要急,让世嘉现在就来讲纯碱是怎么制取的。
最早,人们发现某些海藻晾晒后,烧成灰烬。其中就含有碱类。我们可以直接将其用水浸取,用作洗涤。但是这不太靠谱,不容易大规模获取。草木灰中,也含有碱性物质(K2CO3),也可代替纯碱溶液。

所以,大规模地获取纯碱只有从矿物中获得,这些矿物,一般都埋藏地下,开采不易。
从碱水湖中蒸发结晶,也可以得到纯碱,不过你得知道碱水湖的分布。
世界上三万多个湖泊,只有3个湖泊是碱水湖,一个是墨西哥的Texcoco湖,一个是非洲乍德湖,一个是中国云南的程海湖。

咸水湖的分布可就多了。不要看错,一字之差哦!
如果谈化工合成,最早的是吕布兰法。此方法分为三步,但是这个方法产生的废弃物太高,后来被索尔维法代替。
第一步利用硫酸将食盐转变为硫酸钠:
2NaCl + H2SO4(浓)===Na2SO4 + 2HCl↑
第二步将硫酸钠与木炭、石灰石在炉中共热。炉中硫酸钠与木炭作用后生成硫化钠和一氧化碳:
Na2SO4 + 4C==高温==Na2S + 4CO↑
接着硫化钠与石灰石进行反应,生成碳酸钠和硫化钙:
Na2S + CaCO3==高温==Na2CO3 + CaS
由于产物中混有未反应的黑炭,因此产物呈黑色灰状物,称为黑灰。黑灰中含40%~45%的碳酸钠。
第三步将黑灰用水浸取,溶液经浓缩后碳酸钠结晶析出。硫化钙不易溶于水,沉淀成渣子被弃掉。
索尔维法,又叫做氨碱法。
以食盐(氯化钠)和石灰石(碳酸钙)为原料,生产过程中,氨起了重要的中介作用。先把食盐制成饱和食盐水,吸收氨制成氨盐水;再把石灰石煅烧释出的二氧化碳通入氨盐水中碳化得碳酸氢钠,过滤后煅烧便得纯碱。过滤得的母液含氯化氨,加入石灰乳并蒸馏可回收氨循环使用。此法可连续生产,规模大,产品质量高,成本低。

NaCl+NH3+CO2+H2O===NaHCO3⬇+NH4Cl,
CaCO3=高温=CaO+CO2↑
2NH4Cl+CaO===2NH3↑+CaCl2+H2O
2NaHCO3==Na2CO3+CO2↑ +H2O
有些生存者要问了,氨气怎么制的?如果你不会哈伯的合成氨,那就将尿素加热分解吧。至于尿素,嘿嘿!翻翻过往的文章,或者实在不想翻,就私聊世嘉吧~~
索尔维法比较适合在战时或者设备不齐全的时候实现,铵盐可以循环利用。相反,侯德榜改进后的工艺反而不大适用,
路布兰制碱法,我们再来回顾一下这种制碱方法的流程:NaCl与硫酸作用生成硫酸钠。硫酸钠与石灰石,木炭放入回转窑内加热,反应生成纯碱与硫化钙。将反应过程中产生的固体用水浸泡,由于硫化钙与未反应的木炭不溶于水,因此可以得到纯碱溶液。
这个路线最大的缺点就是流程非常长,而且反应的温度非常高,需要消耗大量能量,同时这个反应从原子经济性来说是不合理的。在反应过程中,利用了硫酸钠,木炭等原料,这些物质最终没有转化为碳酸钠,石灰石中的钙也最后以硫化钙的形式变成了固废,整个过程中物料的浪费都非常严重,产生了大量的副产物。
针对路布兰制碱法的缺点,人们开始逐步采用其他方式生产纯碱。一个被注意到的流程就是所谓的氨碱法流程。
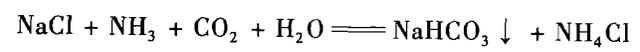

现在我们来看看氨碱法的化学反应过程,反应过程中氯化钠与氨气,二氧化碳和水反应,生成碳酸氢钠与氯化铵,碳酸氢钠分解生成纯碱,水与二氧化碳,后两者可以返回到合成工段充分利用。反应生成的氯化铵可以作为肥料使用,也可以加入石灰进行蒸氨,得到的氨气重新进入合成工段套用。
这个反应从原子经济性的角度来说是非常合理的,所有的反应物均转化为了产物,而宝贵的氨最后也实现了套用。氨气最早被较大规模地在工业上生产出来是在19世纪中期,这时候煤化工开始发展,最早的氨气来源就是炼焦过程中的含氨的吸收液。而在这之前氨气对于工业界来说还是奢侈品。

在一个项目中,我们尝试用搅拌釜做类似氨碱法的反应,氨气利用率只有50%左右,而现代氨碱法可以达到90%。搅拌釜氨气利用率如此低下也难怪那些资本家们亏的血本无归。
索尔维原本致力于提高氨气的吸收效率,最开始他尝试用水进行吸收,但中途却突发奇想地尝试用饱和盐水进行吸收(非常搞笑的是,氨气在氯化钠中的溶解度比在纯水中更小)。
1861年索尔维将这种气体通入盐水中后,他竟然发现水中生成了白色沉淀,这种白色沉淀就是碳酸氢钠。
氨碱法相对与路布兰法减少了很多固相反应与分离过程,尽可能的采用液体或气体物料,这有利于全流程实现连续化生产,增大了系统的产能。氨碱法的另外一个好处是反应过程中不产生黑灰,得到的纯碱品质好,纯度高。正是因为这项改进,纯碱的价格下降了75%。

图中为现代氨碱法流程,主要包括氨盐水制备,碳酸化,重碱煅烧,母液蒸氨等工段,辅助工段为石灰煅烧。区别于之前失败的尝试,索尔维制碱法中大量使用塔器作为吸收设备,大大地提高了吸收效率。
关注本号,头条号私信回复【】内文字,
【医生手册】:可获得极端情况下,医方治疗手册
【卫生员手册】:可获得极端情况下,战地卫生员治疗手册
【民兵】:民兵战斗手册
【军地两用】:军地两用人才上下册
【战士】:战士战场百科
【战后重建】:战后生存百科
相关参考