氯化锡水解离子方程式(从“隐士”到“明星”,锗元素的逆袭)
Posted
篇首语:别裁伪体亲风雅,转益多师是汝师。本文由小常识网(cha138.com)小编为大家整理,主要介绍了氯化锡水解离子方程式(从“隐士”到“明星”,锗元素的逆袭)相关的知识,希望对你有一定的参考价值。
氯化锡水解离子方程式(从“隐士”到“明星”,锗元素的逆袭)
锗元素自身的天然丰度和半金属化学性质,导致了它很晚才被人们发现和认识。而对锗元素的提纯、开采工作,又进一步影响到锗在人类生活中的应用。直到上世纪四十年代末,锗元素才开始真正大放异彩,这次的机遇来自半导体技术的发展。

(图片由“最美丽的化学元素周期表”网站策划者吴尔平提供)
撰文 | 邓耿
编辑 | 李研
以国家命名的元素并不多(只有8种:法国Fr/高卢Ga,德国Ge,俄罗斯Ru,美国Am,日本Nh,波兰Po,另有塞浦路斯Cu),锗便是其中之一。它的英文名Germanium来自于德国国名Germany,这是它的发现者C. A. Winkler(1838 – 1904)为了纪念自己的祖国而命名的(Winkler在弗莱堡矿业学院发现锗元素的1886年,德国主要政权是德意志帝国)。
有趣的是,Ge与同时代发现的镓元素Ga有许多相似之处:它们的命名都来自古国名(Ga的全称Gallium来自于法国古称高卢Gaul),原子序数相邻,都位于第四周期。不过其中最重要的相似之处是,它们的发现都对元素周期律起到了关键的证实作用,尤其是锗。
表面上看,元素的发现与利用是一个历史问题,但同时又有着深刻的自然科学本质。某种元素的丰度高低与它们被发现的时代早晚呈现正相关,而发现时代与它们的性质又共同决定了它们被利用的方式和程度,因此自然性质仍是元素开发的根本因素。回顾锗元素的发现及其利用,便可以看出这一点。
隐居的碳族元素
在五种稳定的碳族元素中,锗是最晚被发现的。如果把碳族元素按照大陆地壳中的天然丰度排序,依次是硅(24.4%)、碳(0.2%)、铅(12.6 ppm)、锡(1.5 ppm),最后才是锗(1.25 ppm)[1]。人类早在原始时代就发现了碳元素单质(石墨和金刚石),青铜时代则围绕着对锡和铅(二者与铜的合金即为青铜)的利用展开,虽然硅单质的提纯要到十九世纪之后,但二氧化硅(水晶或硅石)等硅酸盐类化合物也是近代化学诞生之前就已经广为人知的了。由此可见,天然丰度的高低显著影响了元素被发现的早晚。
相对于它的同族“兄弟”元素而言,锗元素除了天然丰度低这一基本因素外,还有其他一些阻碍它被人们发现和利用的特点。由于处在金属和非金属的交界线上,锗元素是典型的半金属,兼具金属性和非金属性,这使得锗元素在早期分析化学不发达的情况下难以被辨识出来。锗的原子半径和结构特征与同族的硅和锡十分接近,这使得它的成矿情况十分复杂。既不像碳一样有众多共价化合物,又不像锡和铅那样容易形成组分单一的氧化物或硫化物矿石。天然存在的锗元素绝大多数都以锡或铅的伴生矿藏形式存在,藏身于金属被提取之后的矿渣中,以致于在十九世纪之前长期不为人所知,尽管其丰度只比锡少了20%。
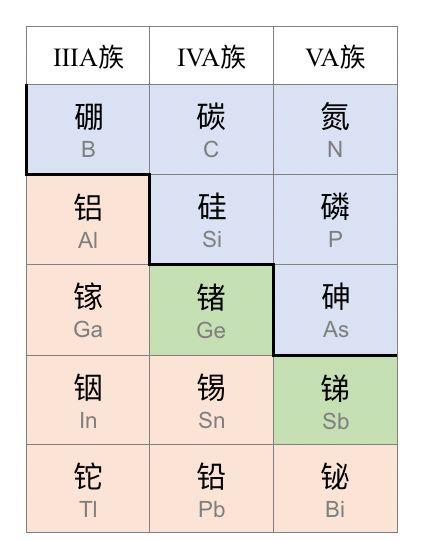
锗在元素周期表中的位置。蓝色:非金属;绿色:半金属;橙色:金属
艰难的发现历程
1885年夏天,弗莱堡矿业学院的矿物学教授A. Weisbach在当地发现了一种新的硫化物矿石,并将其命名为 “Argyrodite(今日名为“硫银锗矿”Ag8GeS6)”。经过定性分析,Weisbach发现其中含有硫、银和少量汞元素,随后他请同校的Winkler对其进行定量的分析。Winkler分析出其中含有73-75%的银、17-18%的硫,但还有大约6-7%的成分无法确认。他猜测这是一种新的元素,采用定性分析方法发现,这种元素可在酸性硫化氢溶液中生成沉淀,并且这一沉淀可被多硫化物进一步转化为硫代酸盐,与硫化氢系统中的砷、锑、锡类似。
Winkler接下来便试图采用化学方法将这种元素的单质提纯出来,但是锗元素的半金属性险些让这工作无功而返。当时化学家已经熟知硫化氢分组体系中砷分组的提纯方法, Winkler将矿石与硫黄和碳酸钠共熔,顺利得到了硫代酸盐,加水浸取后用少量稀盐酸处理,除去预先析出的砷和锑。接下来,Winkler按照常规流程继续加入稀盐酸,此时溶液本应该析出未知元素的硫化物沉淀,但却析出了硫单质的黄色沉淀,这让Winkler百思不得其解。按道理说,未知元素既没有随沉淀析出,也没有随硫单质析出,应该仍然留在溶液中。于是Winkler将溶液蒸干,结果只得到了盐酸与硫代酸钠中和后的氯化钠。
今天我们已经知道,由于锗是半金属,其硫化物的共价性要弱于砷分组的硫化物,所以其溶解度(0.55g/100g水)也比难溶的硫化砷要高。因此,多硫代锗酸盐遇到稀盐酸时并不像砷的硫代酸盐Na3AsS4一样生成硫化砷沉淀和硫化氢气体,而是得到溶解后的硫化锗和硫化钠溶液,多余的硫以单质形式析出。因此Winkler的上述分离方法不能奏效,最终少量的锗还是混在溶液中无法分离。在经过了四个月的错误探索后,1886年2月6日,Winkler偶然将浓盐酸加入溶液中,这时突然析出了大量白色沉淀。Winkler意识到这才是硫化锗GeS2,于是将其过滤吹干,并通过氢气还原,终于制得了灰色的锗单质[2]。

发现并命名锗元素(元素名见倒数第六行)的论文 (图源:参考资料[3])
门捷列夫的神预言
锗元素的发现为验证元素周期律的预言提供了绝好的素材。1867年,在经历了长期探索和传奇式的启示之后,门捷列夫提出了化学史上最重要的发现之一——元素周期律,这是一般读者们都耳熟能详的故事。不过门捷列夫的天才不仅体现在发现了元素性质的周期性重复,他的高明之处在于大胆地在表格中留下了有待于填补的空白。例如他在第三主族的铝和铟之间预测了“类铝”,后来被证实是镓。
锗元素发现之初,由于其属于硫化氢系统中的砷分组,Winkler主张将其定为门捷列夫预言中的“类锑”。但随后经过对锗元素物理化学性质的仔细分析之后,Winkler认定它就是介于硅和锡之间的“类硅(Eka-silicium,Es)”,其实验数据与门捷列夫的预言惊人的一致[4]。从此,元素周期律不再有有力的质疑。锗元素也因此成为了元素周期律最终被证实的关键证据。

门捷列夫预言的“类硅”和锗性质的比较(图源:参考资料[5])
用武之地在何方
锗元素自身的天然丰度和半金属化学性质,导致了它很晚才被人们发现和认识。而对锗元素的提纯、开采工作,又进一步影响到锗在人类生活中的应用。
弗莱堡附近的硫银锗矿Ag8GeS6含锗量最多只有6.38%,并且混合在其它含硫矿物中,难以被商业利用。Winkler曾经尝试从80公斤原始矿物中提取锗单质,结果只得到156克,产率0.195%[6]。因此,在锗元素被发现后,一直仅有少量专业化学家研究其性质,没有大规模开采。
1916年后,陆续有新的锗矿被发现,使得锗的来源大大增加。1916年,新泽西锌业公司的G. H. Buchanan报道了从来自密苏里、威斯康辛和墨西哥的闪锌矿石中提取锗的工作[7],由于闪锌矿矿藏丰富,虽然其含锗量很少(0.025%左右),但仍具有足够的开采价值。
1921年8月,柏林工业大学的von Geh. B. Pufahl在一战前的德国殖民地、西南非洲的楚梅布(Tsumeb)发现了含有GeO2的锗石,其含锗量可以达到6%以上[8],这刺激了大公司开采锗的计划。
1924年,宾夕法尼亚大学的J. H. Muller又在菱锌矿中发现了锗[9]。这些发现使得锗单质及其相关化合物(如二氧化锗和四氯化锗)的商业化生产成为可能。
有了可商业利用的锗供应,锗元素的进一步应用才成为可能。最早的实际应用可能是在石英中掺杂二氧化锗得到的锗玻璃(1925年)[10],其独特的红外透射性质引起了研究者的兴趣,不过真正得以大规模使用还是半个世纪之后的事情。到了四十年代末,锗元素开始真正大放异彩,这次的机遇来自半导体技术的发展。
第一个半导体三极管
十九世纪末,人们已经发现一些矿物晶体具有独特的导电性质,例如方铅矿(PbS)或者黄铁矿(FeS2)与探针接触时具有单向导电性,因此无线电领域最早的检波器就是用方铅矿晶体制作的(1874年)。不过,天然矿石的加工制造和稳定性都不能满足大规模生产的需求,因此早期电子电路的整流器和放大器还是依赖于二十世纪初发明的真空二极管(1904年)和三极管(1907年)。然而,真空电子管的体积很大、结构笨重、能耗较高,并且容易损坏,例如1946年的第一台电子计算机ENIAC用了18000个真空电子管,总重量达到30吨,但计算能力还不如今天的便携计算器。
找到合适的半导体,并用其制成晶体管元件,是二十世纪早期固体物理学家们探索的方向之一。早期人们认识的半导体大多为金属硫化物或氧化物,但实际上更合适是半金属单质(硅或锗)。根据二十世纪三十年代之后发展起来的能带理论,材料的禁带宽度决定了其导电能力。金属的禁带宽度是0,而绝缘体的禁带宽度则很大,例如金刚石的禁带宽度为5.47 eV。相比于绝缘体,半导体的禁带宽度接近0,比如锗的禁带间距就十分窄(0.66 eV),这使得其具有独特的导体性质。
纯净的锗本身几乎不导电,但在其中掺杂上了不同元素之后就会具有不同的性质:锗原子的价层有四个电子,如果掺入价层有三个电子的镓、铟等元素,它的晶格结构基本上不变,但晶体会因此少了一些带负电的电子,物理学家将其等效视为增加了一些带正电的“空穴”。在这样的掺杂晶体中,空穴代替金属中的电子,成为载流子,整体晶体被称为空穴型或P型半导体。与之相反,如果掺入价层有五个电子的砷、锑等元素,则电子成为载流子,晶体被称为电子型或N型半导体。由于载流子不同,如果把常规导体(如金属线)与半导体、或N型与P型半导体相互接连起来,就会在交界处形成电势差,从而实现检流功能。
锗的商业化为上述应用前景提供了必要的准备条件。二次世界大战期间,由于军事方面对雷达和无线电技术的大量需求,英美不少研究机构都投入精力研究半导体器件,锗和硅此时进入了人们的研究视野,在美国尤其以K. Lark-Horovitz在Purdue大学的研究组对锗的纯化及其器件功能进行了丰富详细的研究[11]。他们和同时期贝尔实验室的W. Shockley领导的研究组保持着密切的交流,1947年12月16日,Shockley组的J. Bardeen和W. H. Brattain使用Lark-Horovitz提供的锗元件[12]制造出了第一个点接触式半导体三极管[13]。

1948年Bardeen和Brattain制造的第一个半导体三极管
凭借着独特的性质,从1947年到1960年,锗在半导体原件制造业中扮演了核心地位,大多数元件都是以锗晶体为核心生产出来的。1948年Bell实验室制得了单晶锗,此后发展了提纯锗的区域熔炼技术和掺杂原子技术。
然而,1960年之后锗元素在电子工业中的核心地位却迅速被硅所取代。
转移主战场
究其原因,首先锗的含量有限,与硅相比其地壳含量只有二十万分之一,长远来看是不划算的。其次锗的化合物不如硅稳定,尤其是二氧化硅在常温常压下有着非常好的强度和耐腐蚀性,可以用来保护硅晶体,但二氧化锗则是一种能溶于水的物质[14]。与锗相比,虽然硅的禁带更宽,电子和空穴迁移率不如锗,但依然是一种性能很好的半导体,Bardeen等人在发表三极管工作的时候就已经指出二者可以相互替代。硅的提纯技术与锗同时也在发展,但由于二氧化硅熔点较高,直到二十世纪五十年代后期Bell实验室才开发出可靠的工艺制造单晶硅,这也为硅的大规模利用铺平了道路[15]。
今天几乎所有的集成电路都使用硅作为基本材料,其年产量高达800万吨左右,是锗的四万倍。但由于锗的载流子迁移率和散热性都比硅要优秀,在某些高速开关和需要密集散热的元件上还要使用锗作为材料。
当然,今天锗主要的消耗已经不是半导体部件,而是其他一些应用,例如红外光学元件和合成催化剂。前者是由于锗单晶以及掺杂锗的晶体对红外光具有很好的透射效果,在红外光谱、成像、透视以及要使用红外光完成特定功能的光学器件中广泛使用锗作为材料。而后者则是由于聚酯工业中需要使用二氧化锗作为催化剂,它的生物相容性好,反应条件温和,相比传统含锑催化剂而言对人体更加友好。

红外锗透镜(图源:dm-optical.com)
锗资源是十分稀有的,十九世纪末发现的一些矿藏都已不再具有开采价值。除了前面提到的锌矿、铜矿伴生的锗矿之外,二十世纪中期人们又发现煤层中可能含有远古生物富集的锗元素,并且集中在燃煤粉尘和残渣中[16]。世界已经探明的锗储量估计有12000吨,有三分之二分布在中国,其中又以内蒙古的褐煤矿以及云南的锌铜矿为主。当前锗的全球产量大约在150吨到200吨之间,中国每年产出100吨以上[17]。按此估计,现有的锗资源将在不到一个世纪的时间内枯竭。而随着电子工业和红外元件的发展,预计未来对锗元素的需求并不会减少,甚至有可能增加。因此全球锗元素的流失与回收将是未来稀散金属利用的重要课题,而这又将与锗元素的化学性质紧密相关。围绕着利用与开发锗元素的故事还没有完结……
参考资料
[1] 数据来源:Geochemical Earth Reference Model
[2] M. E. Weeks, The Journal of Chemical Education. (1932). 9 (9): 1605–1619
[3] C. Winkler, Berichte der Deutschen Chemischen Gesellschaft. (1886). 19: 210–211
[4] C. Winkler, J. Prak. Chemie(in German). (1887). 36 (1): 177–209.
[5] 赵匡华:《107种元素的发现》,北京:北京出版社,1983年,第148页
[6] G. H. Buchanan,Journal of Industrial & Engineering Chemistry, (1917). 9, 7, 661-663
[7] G. H. Buchanan, Journal of Industrial & Engineering Chemistry, (1916). 8, 7, 585-586
[8] Von Geh. B. Pufahl, Metall und Erz. Zeitschrift fur Metallhuttenwesen und Erzbergbau einschl, Aufbereitung. XIX. (1922), 13, 324-325
[9] J. H. Müller, Industrial & Engineering Chemistry, (1924), 16, 6, 604-605
[10] E. G. Rochow, Industrial & Engineering Chemistry, (1963), 55, 3, 32-35
[11] F. Seitz, Physics Today. (1995), 48, 1, 22-27
[12] M. Riordan, L. Hoddeson, in Facets: New Perspectivies on the History of Semiconductors, New Brunswick: IEEE Center for the History of Electrical Engineering, (1997), 1-33.
[13] J. Bardeen, W. H. Brattain, Physical Review, (1948), 74(2): 230-231
[14] 《无机化学丛书:锗分族》,北京:科学出版社,1988年,第360页
[15] P. Seidenberg, in Facets: New Perspectivies on the History of Semiconductors,New Brunswick: IEEE Center for the History of Electrical Engineering, (1997), 35-74
[16] A. J. Headlee, R. G. Hunter, Industrial & Engineering Chemistry, (1953). 45(3), 548-551.
[17] 中国有色金属工业协会主编,中国稀散金属,北京:冶金工业出版社,2014年,第105-157页
来源:赛先生
编辑:小林绿子
相关参考
利用氯化亚锡检测水中总磷的原理,其实跟可溶硅等一些物质的测定很相似。都是利用水中所检测物质能够与钼酸铵或其他试剂发生反应形成络合物,这些络合物能够再次被氯化亚锡还原成钼蓝或其他物质,在一定范围内可以对...
高中无机化学方程式大全!一、碱金属单质1.钠在空气中缓慢氧化:4Na+O2=2Na2O2.钠在空气中燃烧:2Na+O2Na2O23.钠与水反应:2Na+2H2O=2NaOH+H2↑现象:①钠浮在水面上;②熔化为银白色小球;③在水面上四处游动;④伴有嗞嗞响声...
氯化银和氨水反应(高中所有化学离子共存、离子检验、离子方程式)
...析离子相关的知识点,包含离子共存、离子检验、常见的离子方程式、与量有关的离子方程式的书写~离子共存离子共存,实质上就是看离子间是否发生反应。若在溶液中发生反应,就不能共存。看能否发生反应,不仅是因为有...
镁的由来镁(Mg)是宇宙中第九丰富的元素,它生成于巨大的老年恒星内部,由三个氦原子核相继加入一个碳原子核形成新的镁核。当像超新星这样的恒星爆炸时,大部分的镁被散射到星际介质中,在那里镁可以循环进入新的恒...
氢氧化钠加氯化钡化学方程式(初中化学需要记住的元素符号和化学式,暑假提前背)
领取更多学习资源请关注公众号:初中资源园地化学是一门比较特殊的科学,而元素符号和化学式是我们打开化学这扇神秘大门的钥匙!掌握元素符号和化学式的知识是我们学好化学的基础。现将这部分知识总结如下,希望对大...
微量元素包括硼、锌、钼、铁、锰、铜等营养元素。虽然植物对微量元素的需要量很少,但它们对植物的生长发育的作用与大量元素是同等重要的,当某种微量元素缺乏时,作物生长发育受到明显的影响,产量降低,品质下降。...
1、鎓是一个汉语词语,拼音是wēng,古义为锹。2、化学定义:鎓化合物是由氮族元素、氧族元素、卤素的单核氢化物被质子化得到的阳离子,以及一些用其他基团(例如有机自由基、卤素原子、四甲基铵)取代氢原子形成的衍...
1、鎓是一个汉语词语,拼音是wēng,古义为锹。2、化学定义:鎓化合物是由氮族元素、氧族元素、卤素的单核氢化物被质子化得到的阳离子,以及一些用其他基团(例如有机自由基、卤素原子、四甲基铵)取代氢原子形成的衍...
...氯化钠反应的化学方程式为:AgNO3+NaCl=AgCl↓+NaNO3,且它的离子方程式为:Ag++Cl-=AgCl↓。 硝酸银的化学式为AgNO3,氯化钠的化学式为NaCl,根据硝酸银和氯化钠反应的化学方程式可以知道,这个化学反应在反应前以及反应后各元...
1、第一周期:氢、氦(侵害)。2、第二周期:锂、铍、硼、碳、氮、氧、氟、氖(鲤皮捧碳蛋养福奶)。3、第三周期:钠、镁、铝、硅、磷、硫、氯、氩(那美女桂林留绿牙)。4、第四周期:钾、钙、钪、钛、钒、铬、锰(...