氨基酸在蛋白质构象中的作用(蛋白质的三级结构)
Posted
篇首语:人的影响短暂而微弱,书的影响则广泛而深远。本文由小常识网(cha138.com)小编为大家整理,主要介绍了氨基酸在蛋白质构象中的作用(蛋白质的三级结构)相关的知识,希望对你有一定的参考价值。
氨基酸在蛋白质构象中的作用(蛋白质的三级结构)
蛋白质的形状对其功能至关重要,因为它决定了蛋白质能否与其他分子相互作用。蛋白质的结构可分为一级结构、二级结构、三级结构和四级结构。
一级结构
蛋白质的一级结构是构成蛋白质的每个多肽链中的所有氨基酸序列。实际上,这只是一个多肽链中氨基酸排列顺序的列表,而不是一个结构。但是,由于最终的蛋白质结构最终取决于这个序列,这被称为多肽链的初级结构。例如,胰腺激素胰岛素有两个多肽链,A和B。
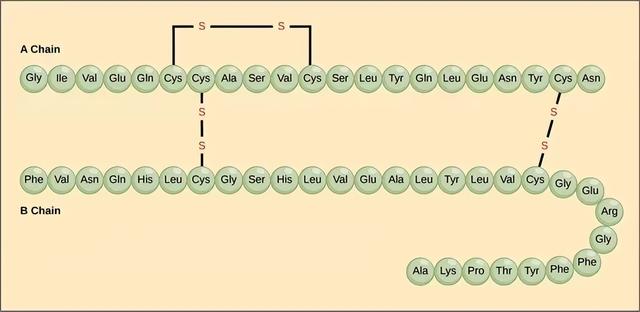
一级结构胰岛素的A链长21个氨基酸,B链长30个氨基酸,每个序列都是胰岛素蛋白所特有的。
二级结构
蛋白质的二级结构是指当多肽开始折叠成具有功能的三维形式时,相邻或相邻氨基酸之间的相互作用所产生的任何规则结构。二级结构出现在多肽链的一个区域的氨基酸的局部基团之间形成氢键。很少有一个二级结构延伸到整个多肽链。它通常只是链条的一部分。最常见的二级结构形式是α-螺旋和β-折叠片状结构,它们在大多数球状和纤维状蛋白质中起着重要的结构作用。
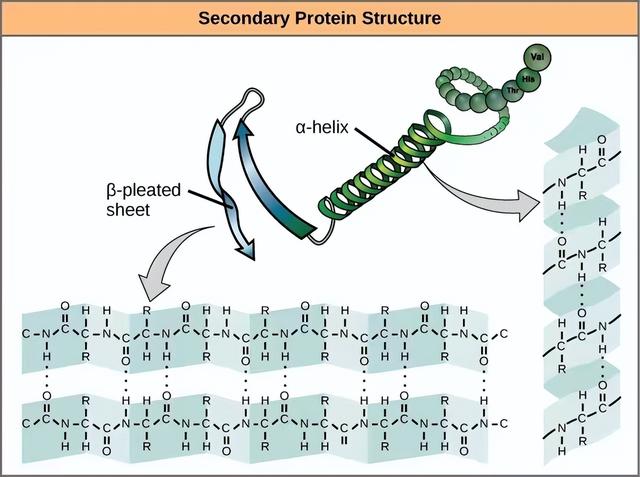
α-螺旋和β-折叠
在α-螺旋链中,一个氨基酸的多肽主链羰基中的氧原子与另一个氨基酸的多肽主链氨基中的氢原子之间形成氢键,后者是沿链更远的四个氨基酸。这将氨基酸的伸展保持在右手盘中。α螺旋中的每一个螺旋圈都有3.6个氨基酸残基。多肽的R基团(侧链)从α-螺旋链中伸出,不参与维持α-螺旋结构的氢键。
在β-折叠片中,由于单个C-C和C-N共价键的非线性性质,氨基酸的伸展部分以几乎完全伸展的构象“褶皱”或“之”字形。β-褶皱床单从来不会单独出现。它们必须用其他β-折叠床单固定。由于一个β-折叠片的多肽主链羰基中的氧原子与另一个β-折叠片的多肽主链氨基中的氢原子之间形成氢键,因此β-折叠片中的氨基酸片段保持在其折叠片结构中。β-褶皱的薄片相互连接在一起,彼此平行或反平行排列。β-折叠片中氨基酸的R基团指向与将β-折叠片固定在一起的氢键垂直的方向,与维持β-折叠片结构无关。
三级结构
多肽链的三级结构是指所有二级结构元素相互折叠后的整体三维形状。多肽链中极性、非极性、酸性和碱性R基团之间的相互作用形成了蛋白质复杂的三维三级结构。当蛋白质在体内的水环境中折叠时,非极性氨基酸的疏水性R基团主要位于蛋白质的内部,而亲水性的R基团则主要位于蛋白质的外部。半胱氨酸侧链在氧气存在下形成二硫键,这是蛋白质折叠过程中形成的唯一共价键。所有这些相互作用,无论是弱的还是强的,都决定了蛋白质最终的三维形状。当一个蛋白质失去了它的三维形状,它就不再有功能了。
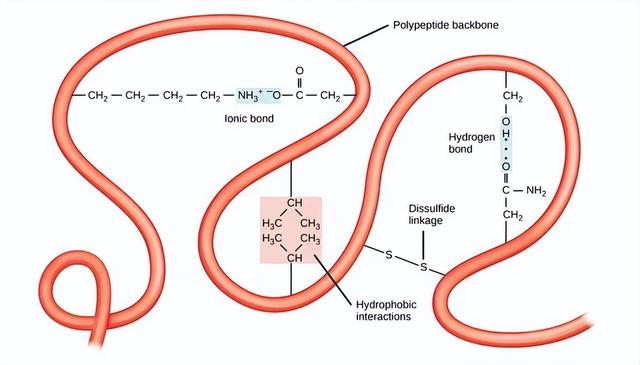
三级结构蛋白质的三级结构由疏水相互作用、离子键、氢键和二硫键决定
四级结构
蛋白质的四级结构是指它的亚基是如何相互定向和排列的。因此,四元结构只适用于多亚单位蛋白质,即由一个以上多肽链组成的蛋白质。由单一多肽合成的蛋白质不会有四级结构。
在含有多个亚基的蛋白质中,亚基之间的弱相互作用有助于稳定整体结构。亚单位通常是形成最终功能的关键酶。
例如,胰岛素是一种球状的球状蛋白质,含有氢键和二硫键,将两条多肽链连接在一起。蚕丝是一种纤维蛋白,由不同β-折叠链之间的氢键作用而成。
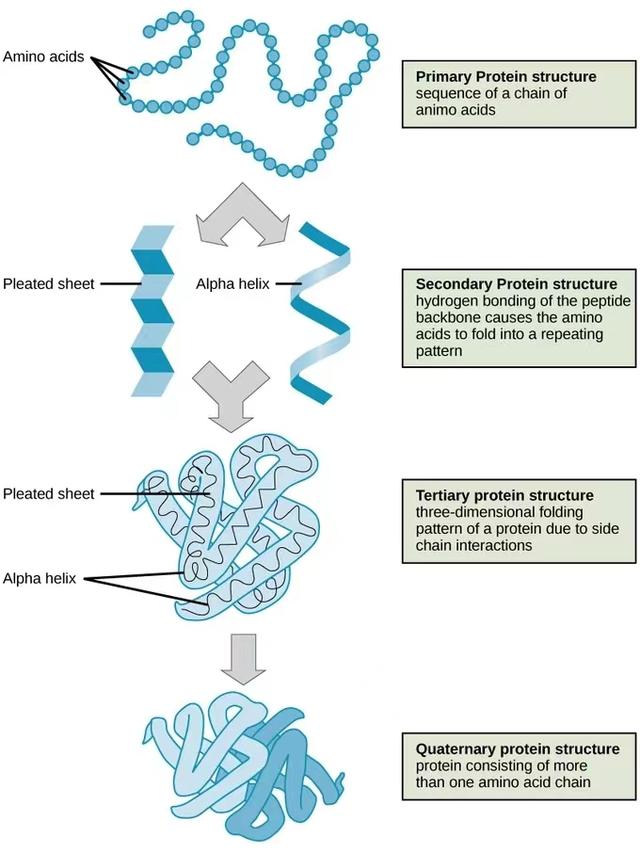
上图可以看到蛋白质结构的四个层次
相关参考