氢氧化银分解化学方程式(初三化学:整本书的“知识框架图”,让你完美逆袭)
Posted
篇首语:常勤精进,譬如水长流,则能穿石。本文由小常识网(cha138.com)小编为大家整理,主要介绍了氢氧化银分解化学方程式(初三化学:整本书的“知识框架图”,让你完美逆袭)相关的知识,希望对你有一定的参考价值。
氢氧化银分解化学方程式(初三化学:整本书的“知识框架图”,让你完美逆袭)
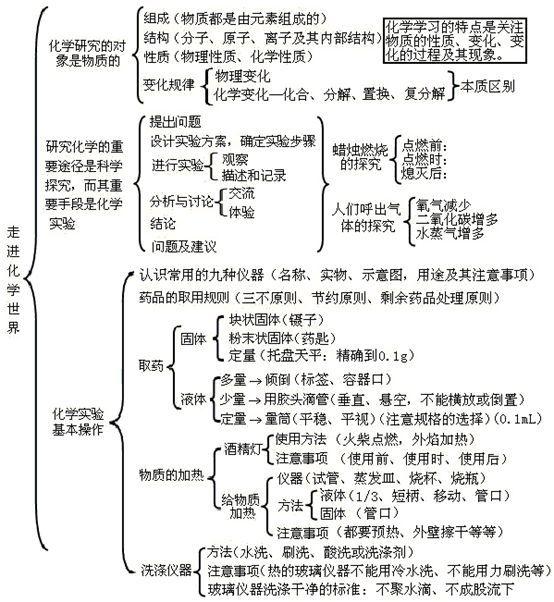
第一单元:走进化学世界
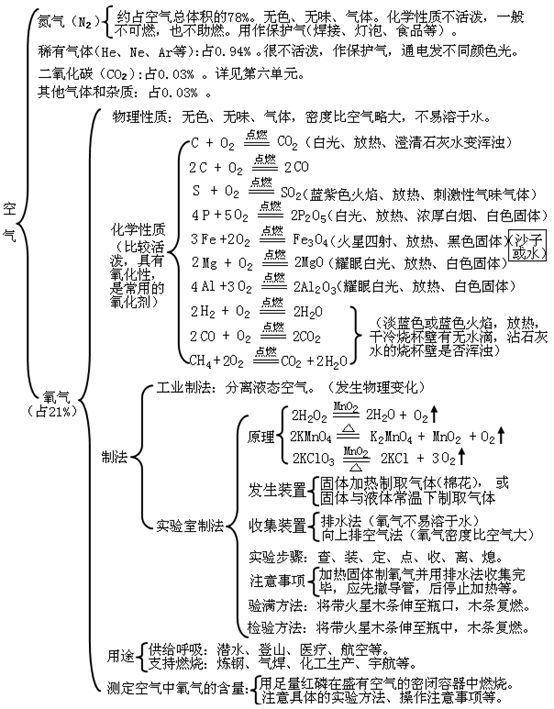
第二单元:我们周围的空气
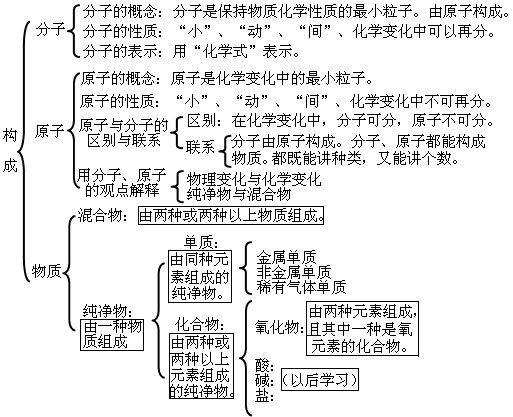
第三单元:自然界的水

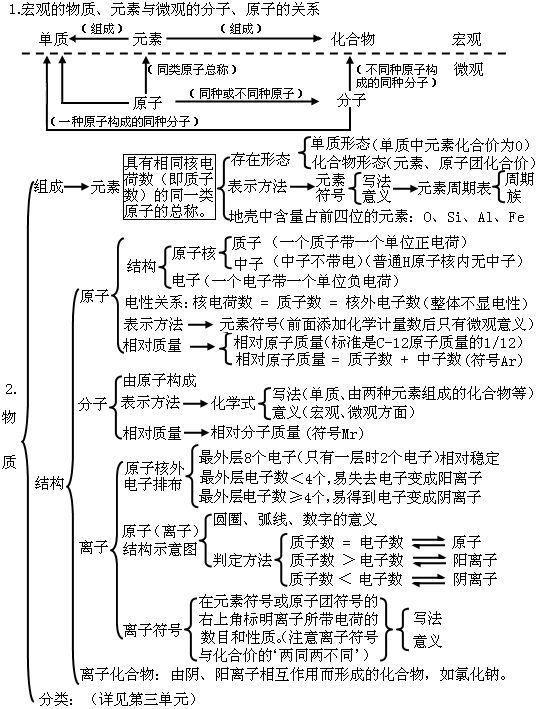
第四单元:物质构成的奥秘
第五单元:化学方程式
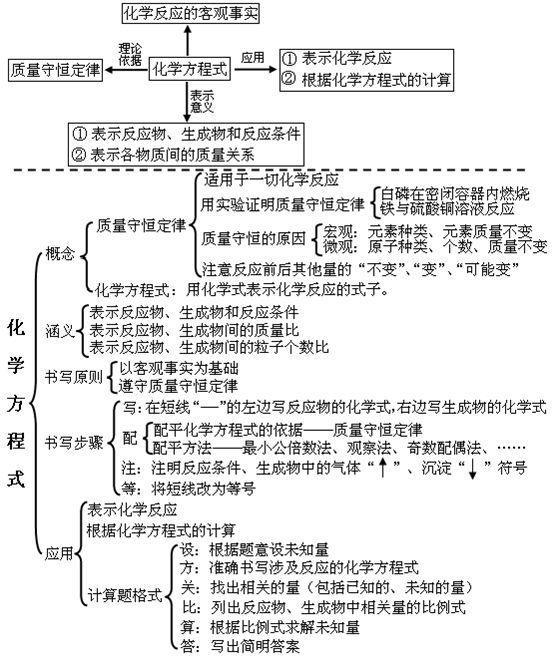
第六单元:碳和碳的氧化物

第七单元:燃料及其利用
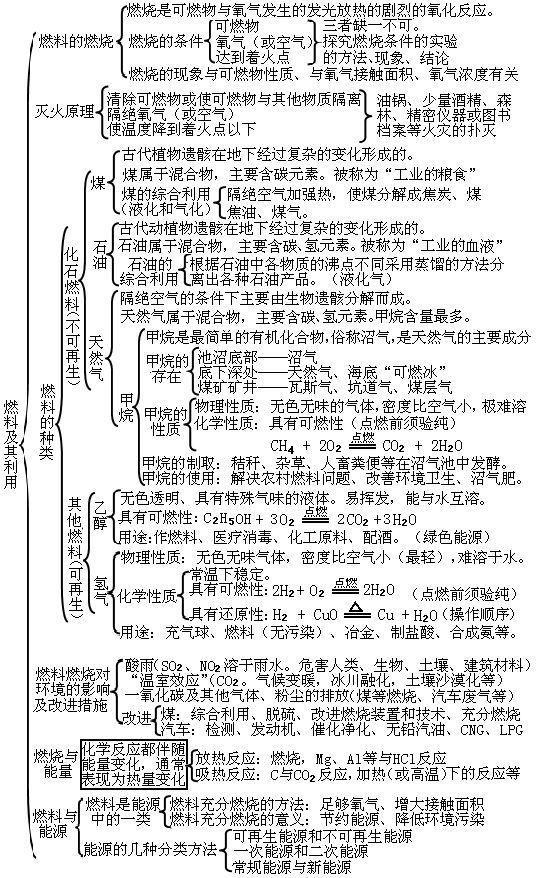
第八单元:金属和金属材料

第九单元:溶液
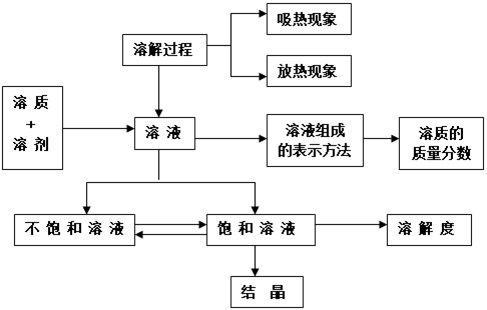
第十单元:酸 碱 盐
化学用语01
1、电离方程式:
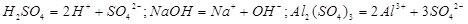
2、物质的俗称和主要成分:
生石灰CaO;
熟石灰、消石灰、石灰水的主要成分Ca(OH)2;
石灰石、大理石CaCO3;
食盐的主要成分NaCl ;
纯碱、口碱Na2CO3;
烧碱、火碱、苛性钠NaOH;
胆矾、蓝矾CuSO4·5H2O;
碳酸钠晶体Na2CO3.10H2O;
氨水NH3.H2O。
金属活动性02
1、金属活动性顺序:
K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au
2、金属活动性顺序的意义:
在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:
(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
酸、碱、盐的溶解性03
1、常见盐与碱的溶解性:
钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:
氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁
3、四微溶物:
Ca(OH)2(石灰水注明“澄清”的原因)、
CaSO4(实验室制二氧化碳时不用稀硫酸的原因)
Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)、
MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)
4、三个不存在的物质:
氢氧化银、碳酸铝、碳酸铁
复分解反应发生的条件反应04
有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)
1、不溶性碱只能与酸性发生中和反应;
2、不溶性盐,只有碳酸盐能与酸反应;
3、KNO3、NaNO3、Agcl 、BaSO4不能做复分解反应的反应物。
溶液的酸碱性与酸碱度的测定05
1、指示剂---溶液的酸碱性紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝
无色的酚酞试液只遇碱溶液变红
注:不溶性碱与指示剂无作用;
碱性溶液不一定是碱的溶液(特例:碳酸钠的水溶液显碱性)
2、pH值---溶液的酸碱度:
pH<7溶液为酸性(越小酸性越强);
pH=7溶液为中性;
pH>7溶液为碱性(越大碱性越强)
离子的检验06
Cl-(在溶液中)---在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。
SO42-(在溶液中)---在被测溶液中加入氯化钡(或硝酸钡、或氢氧化钡)溶液,如果生成不溶于硝酸(或盐酸)的白色沉淀,则原被测液中含硫酸根离子。
CO32-
(1)(固体或溶液)---在被测物质中加入稀酸溶液,如果产生能使澄清石灰水变浑浊的气体,则原被测物质中含碳酸根离子。
(2)(在溶液中)---在被测溶液中加入氯化钡或硝酸银溶液,如果产生能溶于硝酸的白色沉淀,且同时生成能使澄清的石灰水变浑浊的气体,则原被测溶液中含碳酸根离子。
1、在鉴别Cl-和SO42-时,用氯化钡溶液,不要用硝酸银溶液,这是因为硫酸银为微溶性物质,使鉴别现象不明显;
2、在一未知溶液中加入氯化钡溶液,若产生不溶于硝酸的白色沉淀,则原被测液中可能含银离子也可能含硫酸根离子。
物质的颜色07
1、固体(多为白色)
黑色---CuO、C粉、MnO、2Fe3O4、
紫黑色---KMnO4
红色---Cu、Fe2O3
红褐色---Fe(OH)3
蓝色---Cu(OH)2、CuSO4.5H2O 绿色---Cu2(OH)2CO3
2、溶液(多为无色)
浅绿色溶液---(亚铁盐溶液)FeCl2溶液、FeSO4;
黄色溶液--- (铁盐溶液)FeCl3溶液、Fe2(SO4)3 溶液、Fe(NO3)3;
溶液蓝色溶液---(铜盐溶液)CuCl2溶液、CuSO4溶液、Cu(NO3)2;
溶液蓝绿色溶液-CuCl2溶液(较浓)。
酸、碱、盐的特性08
1、浓盐酸---有挥发性、有刺激性气味、在空气中能形成酸雾。
2、浓硝酸---有挥发性、有刺激性气味、在空气中能形成酸雾,有强氧化性。
3、浓硫酸---无挥发性。粘稠的油状液体。有很强的吸水性和脱水性,溶水时能放出大量的热。有强氧化性。
4、氢氧化钙---白色粉末、微溶于水。
5、氢氧化钠---白色固体、易潮解,溶水时放大量热。能与空气中的二氧化碳反应而变质。
6、硫酸铜---白色粉末、溶于水后得蓝色溶液(从该溶液中析出的蓝色晶体为五水合硫酸铜CuSO4.5H2O)。
7、碳酸钠---白色粉末,水溶液为碱性溶液(从溶液中析出的白色晶体为碳酸钠晶体Na2CO3.10H2O)。
8、氨水(NH3.H2O)---属于碱的溶液。
酸与碱的通性和盐的性质09
1、酸的通性
(1)酸溶液能使紫色的石蕊试液变红,不能使无色的酚酞试液变色;
(2)酸能与活泼金属反应生成盐和氢气;
(3)酸能与碱性氧化物反应生成盐和水;
(4)酸能与碱反应生成盐和水;
(5)酸能与某些盐反应生成新的盐和新的酸。
2、碱的通性
(1)碱溶液能使紫色的石蕊试液变蓝,并能使无色的酚酞试液变红色;
(2)碱能与酸性氧化物反应生成盐和水;
(3)碱能与酸反应生成盐和水;
(4)某些碱能与某些盐反应生成新的盐和新的碱。
3、盐的性质
(1)某些盐能与较活泼的金属反应生成新的盐和金属;
(2)某些盐能与酸反应生成新的盐和新的酸;
(3)某些盐能与某些碱反应生成新的盐和新的碱。
www.nobook.com
让教学更简单
长按扫码可关注
相关参考
...物=盐+水(3)碱+酸=盐+水(4)碱+某些盐=另一种盐+另一种碱1、氢氧化钠跟二氧化碳反应:2NaOH+CO2=Na2CO3+H2O2、氢氧化钠跟二氧化硫反应:2NaOH+SO2=Na2SO3+H2O3、氢氧化钠跟三氧
氢氧化钙溶于水吗是微溶吗(化学复习笔记——记忆篇,初三化学常见物质的性质和用途)
气体类:物质物理性质化学性质用途氧气O2通常情况下,氧气是一种无色、无味的气体。不易溶于水,密度比空气略大,可液化和固化。氧气是一种化学性质比较活泼的气体,能与许多物质发生化学反应,在反应中提供氧,具有...
今天给大家分享水的净化过程,要了解自来水厂水的净化过程,重点掌握过滤操作哦,还要能区别硬水和软水,知道它们怎样鉴别。知识点一:化学式1.化学式的定义:用元素符号和数字的组合表示物质组成的式子,叫做化学式...
氧化镁的化学表达式是什么(初三化学上册期末复习:考前冲刺100道精选例题,抓紧练习查漏补缺)
1.化学变化的基本特征?有新物质生成2.化学变化的关键词(至少5个)燃烧、腐蚀、变质、酿酒、光合作用、呼吸作用、生锈3.描述水的构成奥秘①水是由水分子构成的②每个水分子由两个氢原子和一个氧原子构成③水由氢氧元素...
水玻璃与二氧化碳反应(初三化学上册,稀盐酸或稀硫酸与大理石反应制取二氧化碳实验讲解)
...分:碳酸钙)生成二氧化碳、氯化钙和水。文字表达式与化学方程式如下:2、试验仪器与药品仪器:锥形瓶、长颈漏斗、导管、集气瓶药品:大理石:块状固体,由碳酸钙(主要成分)和杂质组成,杂质不与盐酸反应。稀盐酸...
一、纯净物与混合物的定义1、纯净物:有一种物质组成的物质;特点:纯净物有固定的物理和化学性质纯净物可以用一个化学式表示,可以用化学式表示的一定是纯净物举例:1、氧气:由氧气一种物质组成的纯净物,化学式:O...
烧碱和生石灰的化学方程式(初三化学:有关酸碱盐的化学方程式)
单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸---盐+氢气(置换反应)1.锌和稀硫酸Zn+H2SO4=ZnSO4+H2↑(最常用)(实验室制H2用的金属有Zn,Fe,Mg,Al,酸有稀H2SO4和稀HCl)(2)金属单质+盐(溶液)---另一种金属+另一种盐2.铁和硫...
烧碱和生石灰的化学方程式(初三化学:有关酸碱盐的化学方程式)
单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸---盐+氢气(置换反应)1.锌和稀硫酸Zn+H2SO4=ZnSO4+H2↑(最常用)(实验室制H2用的金属有Zn,Fe,Mg,Al,酸有稀H2SO4和稀HCl)(2)金属单质+盐(溶液)---另一种金属+另一种盐2.铁和硫...
木炭焦炭活性炭炭黑是混合物吗(九年级化学碳和碳的氧化物知识点整理,图文并茂,初三同学赶快看)
第6单元碳和碳的氧化物一、碳的几种单质金刚石石墨金刚石和石墨的物理性质有很大差异的原因是:碳原子的排列不同。CO和CO2的化学性质有很大差异的原因是:分子的构成不同。 3、无定形碳:活性炭 由石墨的微小晶体和少量...
氯气是助燃剂吗(化学复习笔记——记忆篇,初三化学常见物质的性质和用途)
气体类:物质物理性质化学性质用途氧气O2通常情况下,氧气是一种无色、无味的气体。不易溶于水,密度比空气略大,可液化和固化。氧气是一种化学性质比较活泼的气体,能与许多物质发生化学反应,在反应中提供氧,具有...