标准状况下一摩尔气体的体积(2022高考化学难度分析,这123条你掌握了,高考化学必90+)
Posted
篇首语:尺有所短;寸有所长。物有所不足;智有所不明。本文由小常识网(cha138.com)小编为大家整理,主要介绍了标准状况下一摩尔气体的体积(2022高考化学难度分析,这123条你掌握了,高考化学必90+)相关的知识,希望对你有一定的参考价值。
标准状况下一摩尔气体的体积(2022高考化学难度分析,这123条你掌握了,高考化学必90+)
基本概念
1.关于物理变化与化学变化
核裂变/核聚变不是化学变化(原子是化学变化中的最小单位);
电解质溶液导电是化学变化,金属导电是物理变化;
电离是物理变化;(无新键生成)
原子核外电子跃迁(如焰色反应)是物理变化;
明矾净水是化学变化;
石墨和金刚石转化(白磷变红磷、O2
变O3……)是化学变化;
无水硫酸铜变五水硫酸铜是化学变化;
2.关于纯净物和混合物
胶体、溶液等是“分散系”,“分散系”包括“分散剂”和“分散质”,因
此是混合物;
聚乙烯、聚丙烯等,n值不完全相同,因此是混合物;
合金属于混合物;
一水合氨(NH3·H2O)属于纯净物,但氨水是混合物;
控制CH4:Cl2=1:1,光照下得到的产物是混合物;
3.关于胶体(分散系)
胶体是混合物!(可以是液溶胶、固溶胶、气溶胶)
氢氧化铁胶体的制备:沸水中滴加饱和氯化铁溶液
胶体不能(用滤纸)过滤,但可以用半透膜(渗析)除去
丁达尔效应的描述(答题模板):看到一条光亮的“通路”
4.关于电解质
电解质定义:在水溶液里或熔融状态下能导电的化合物叫做电解质
(教材出处:部编必修一P13、鲁科必修一P53、苏教必修一P20)
电解质/非电解质一定是化合物:Cu是单质,氨水是混合物,故二者既不是电
解质也不是非电解质(但NH3
·H2O是化合物,属于弱电解质)
溶解度和电解质的强弱没有关系:硫酸钡是强电解质
氧化物与电解质:二氧化碳、二氧化硫不是电解质,因为溶于水之后发生反
应才能导电;氧化钠、氧化铝是电解质,因为(属于离子化合物)熔融之后可以导电
酸与电解质:盐酸、硫酸等液态时不导电但是溶于水导电,是(强)电解质;
硫化氢等在水中部分电离,是弱电解质
5.关于物质分类
过氧化钠不是碱性氧化物!(属于过氧化物)
CO既不属于酸性氧化物也不属于碱性氧化物!
NO2虽然能与水反应生成硝酸,但不是酸性氧化物!(经过了氧还)
NaHSO4不是酸!(电离出阳离子不全为氢离子)
6.“反常的”酸
与P有关:
次磷酸H3PO2,是一元酸;
亚磷酸H3PO3,是二元酸;
磷酸H3PO4,是三元酸
与B有关:
硼酸H3BO3,是一元酸,电离方程式H3BO3+H2O=[B(OH)4]-+H+
7.关于氧化还原(再过一遍基本概念)
氧化剂,得电子,化合价下降,被还原,发生还原反应
还原剂,失电子,化合价上升,被氧化,发生氧化反应
配平注意“2”,如H2C2O4变2CO2,失2电子;
注意同种粒子可能有的参加氧化还原反应,有的没有参加氧化还原反应
8.关于元素的各种概念和参数
,A是质量数,Z是原子序数
质量数和相对原子质量不是一个概念!
质量数是整数(质子数+中子数),没有小数点
“同位素”要求必须质子数相同且中子数不同
同位素必须是核素,如1H和2H是同位素,但1H2
和2H2
不是同位素
问化合价记得标明正负!
9.关于电子式
重点关注:
1. 化学键类型和数目有没有错误(离子键画成共价键、共价键画成离子键)
2. 是否8电子稳定结构
3. 离子记得打括号,标电荷
4. 基团(甲基,…)的电子式有一个单电子
10.共价与离子
AlCl3是共价化合物!
Na2O、Na2O2、Al2O3都是离子化合物!
离子化合物中也可以有共价键:含氧酸盐
也可以有非极性共价键:过氧化钠
11.关于物质的量/气体摩尔体积
溶液中研究粒子物质的量,注意看有没有给定体积;
注意考虑水解或不完全电离;
问几mol化学键,记得把物质展开写(尤其是有机物)
问几mol电子,如果是离子,别忘了要加上/减去所带的电荷
问反应后几mol产物,注意反应是否完全进行(可逆反应?完全燃烧?)
标准状况下1mol气体体积为22.4L
标准状况:0℃,101kPa(不是常温!!)
12.关于溶液的浓度
注意配成溶液之后可能发生的水解或不完全电离:1mol/L碳酸钠溶液中,碳酸根浓度小于1mol/L
溶液的质量分数是溶质质量/溶液质量,如100g质量分数2%的蔗糖溶液中有2g蔗糖98g水
溶解度单位一般是g/100g水,题目给单位时以题目为准
题目给数与22.4有关,先看描述的物质是不是气体
第二节 元素的性质
13.钠的两种氧化物
氧化钠-常温生成-灰白色
过氧化钠-燃烧生成(和水、CO2反应都生成氧气,用于潜艇等)-淡黄色
过氧化钠与水、二氧化碳的反应是Na2O2中氧元素的歧化,一半价下降,一般价上升
例题速览:
(判断)过氧化钠与水反应,生成0.1mol氧气时转移的电子数为0.4NA
答案:错,氧气是从(过氧化钠中的)-1价O来的,而不是水中的-2价O
14.含钠化合物的俗称、性质与用途
NaOH:火碱、烧碱、苛性钠
NaHCO3:小苏打——溶解度小,受热易分解,溶解吸热
Na2CO3:苏打、纯碱——溶解度大,受热不易分解,溶解放热(Na2S2O3:硫代硫酸钠、海波、大苏打)
Na2SO4·10H2O:芒硝
碳酸钠:制肥皂、制玻璃
碳酸氢钠:制药(治疗胃酸过多)、烘焙糕点作膨松剂(鲁科必修一P32-35)
*生理盐水:0.9%氯化钠溶液
*加碘食盐含碘酸钾不含碘单质!
15. 关于焰色反应
用什么工具:铁丝或铂丝
不能用玻璃棒!玻璃中含钠,自己就会产生钠的焰色
*钾的焰色常受钠盐干扰,要透过蓝色钴玻璃观察
16.侯氏制碱法
教材出处:苏教版必修一P73
“制碱”的“碱”指的是纯碱(碳酸钠)
顺序:先通氨气再通二氧化碳
总反应方程式:H2O+NH3+CO2+NaCl=NH4Cl+NaHCO3↓
之后:NaHCO3
加热分解,终产物是碳酸钠,CO2
循环利用
17.关于氯气参与的反应
和Fe、Cu生成FeCl3、CuCl2
(无论少量过量,注意都是最高价态)
和H2在点燃或光照条件下才反应
氯气与湿润石蕊试纸:先变红,再褪色
18.关于漂白
真正起效的物质是HClO,变质也是通过HClO分解来进行
漂白液:有效成分是NaClO
起效方式:ClO-+H2O+CO2=HClO+HCO3-(注意酸性H2CO3>HClO>HCO3
-)
漂白粉(漂粉精):有效成分是Ca(ClO)2
起效方式:Ca2++2ClO+H2O+CO2=2HClO+CaCO3(碳酸钙是沉淀,因此和漂白液不同)
关于漂白性:
SO2、HClO、H2O2具有漂白性
HClO、H2O2的漂白性是氧化性的体现,SO2
漂白性不是氧化/还原性的体现
能写出具体化学方程式的反应都不体现漂白性
活性炭也可使有色物质褪色,但一般不说具有“漂白性”,原理是吸附(物理变化)
19.铁的氧化物(俗称、反应)
教材出处:部编必修一P67、鲁科必修一P86
FeO——不稳定,受热氧化为Fe3O4
Fe3O4——俗称磁性氧化铁,是磁铁矿主要成分,铁单质在氧气中剧烈燃烧、
与高温水蒸气反应、FeO在空气中受热的产物
Fe2O3——俗称铁红,是赤铁矿主要成分,常用于做红色颜料,是铁在空气中
生锈的最终产物
20.铁的氢氧化物(反应、答题模板)
颜色:氢氧化铁 红褐色;氧化铁 红棕色
现象描述:NaOH溶液滴入FeSO4
溶液中:生成白色沉淀,白色沉淀迅速变为灰绿色,然后变为红褐色
21.关于亚铁/铁离子
检验:
Fe2+:铁氰化钾K3[Fe(CN)6](黄色溶液),生成物是蓝色沉淀KFe[Fe(CN)6](普鲁士蓝)
记得打方括号“[ ]”!
Fe3+:硫氰化钾KSCN(无色溶液),溶液变为红色(不生成沉淀!)
性质:Fe2+还原性强于Br-,故向FeBr2溶液中通少量Cl2会先生成FeBr3
*注意铁氰化钾中铁为+3价,有一定的氧化性,可能对实验有干扰
22. 金属单质与水的反应性
按金属活动性分类:
K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au
红色:放在液态水里就能反应
蓝色:遇沸水才能反应
绿色:遇高温水蒸气才能反应
黑色:不与水反应
*Zn略有争议
23.铝化合物的转化
Al3+---Al(OH)3---AlO2-的转化:
铝盐溶液滴加NaOH:先沉淀,后沉淀溶解
铝盐溶液滴加氨水:沉淀,沉淀不溶解
偏铝酸盐溶液滴加HCl:先沉淀,后沉淀溶解
偏铝酸盐溶液通入CO2:沉淀,沉淀不溶解
24.铁、铝与生活
吃:
补铁剂一般是二价铁,补铁剂与维生素C一起服用,因为维生素C具有还原性,
可以避免二价铁被氧化而降低药效;
氢氧化铝可以治疗胃酸过多(和前面提过的碳酸氢钠一样)
用:
制作印刷电路板的原理:镀铜的电路板,把需要保留的电路部分用不透水的
物料覆盖,未覆盖部分被FeCl3溶液腐蚀
红宝石主要成分是氧化铝,红色来源于杂质离子
25.合金
生铁和钢都是铁碳合金,属于混合物;
“硬铝”是一种铝合金
*稀土元素:57-71号元素(镧系元素)和钪、钇,又被称作“冶金工业的维生素”,
我国是稀土资源大国
26.金属的冶炼与获取
按金属活动性分类:
K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au
红色:电解法,电解熔融盐,不是电解盐溶液
蓝色:热还原法,用H2、CO、C等还原剂
绿色:热分解法,氧化物热稳定性一般,加热分解生成单质和氧气
紫色:物理分离(阳极泥等,但实际上也经常用化学方法),化学性质很不活泼,自然界一般就以单质存在
27.硫单质的反应(与氯气对比,不要搞混!)
与铁单质:生成硫化亚铁FeS,铁为+2价
(氯气生成FeCl3,铁为+3价)
与铜单质:生成硫化亚铜Cu2S,铜为+1价
(氯气生成CuCl2,铜为+2价)
歧化:热碱溶液中歧化生成硫化钠和亚硫酸钠
28.二氧化硫通入钡盐
亚硫酸钡和硫酸钡都是白色沉淀;
二氧化硫通入氯化钡溶液,无沉淀,因为弱酸不能制强酸;
二氧化硫和氨气共同通入氯化钡溶液,有沉淀,因为发生酸碱反应生成大量
亚硫酸根离子;
二氧化硫通入硝酸钡溶液,有沉淀,因为硝酸根有氧化性,生成的是硫酸钡;
二氧化硫通入氯化钡,一段时间有沉淀,因为亚硫酸被氧化为硫酸
29. 接触法制硫酸
原料:硫铁矿FeS2(S是-1价)
先:【沸腾炉】粉碎,高温条件下生成Fe2O3
和SO2
再:【接触室】SO2
在催化剂(V2O5)作用下被O2氧化为SO3
后:【吸收塔】用98.3%的浓硫酸吸收三氧化硫,再稀释成不同浓度的产品
(不用水吸收三氧化硫,是为了防止SO3溶于水时反应放出大量热导致酸雾,降低吸收效率)
30.关于浓硫酸
吸水性是物理变化,脱水性是化学变化;
钝化:铁、铝
浓才钝化,不浓不钝化;
常温钝化,加热仍然会反应;
不是不反应,而是迅速生成致密氧化膜阻碍反应
没有挥发性,但用浓硫酸和亚硫酸钠制备二氧化硫时,气体可能会带出一些浓硫酸小液滴
稀释必须酸入水!
31.浓硫酸与铜的反应
注意要点:
反应结束后体系仍为浓硫酸,生成的硫酸铜是白色固体(无水硫酸铜)
试管内物质倒入水中,变为蓝色;
注意顺序,不可将水倒入试管中,理由和浓硫酸稀释相同
(酸入水,慢搅拌;水入酸,就完蛋)
32.含硫化合物与生活
二氧化硫:可以做食品添加剂,添加到葡萄酒等食品中,抗氧化,但要符合国家标准,不能
超标(苏教必修一P92)
除烟气中二氧化硫:2CaCO3+2SO2+O2=▲=2CaSO4+2CO2
硫酸钙:俗称石膏,生石膏是CaSO4·2H2O,熟石膏是2CaSO4·H2O,用于固定骨折部位等,粉笔主要是石膏
硫酸铜:五水硫酸铜CuSO4·5H2O为蓝色,俗称胆矾或蓝矾,可用于配制农药;
无水硫酸铜为白色,可用于检验水蒸气
硫酸钡:俗称重晶石,不溶于水和酸,不易被X射线穿透,因此硫酸钡悬浊液又称“钡餐”,
用于消化系统X射线检查(苏教必修一P97)
明矾:化学式为KAl(SO4)2·12H2O,用于净水(不是消毒,是水解原理的应用)
绿矾:FeSO4·7H2O
33.关于氨气
液氨可用作制冷剂(汽化大量吸热)
加热NH4Cl固体不能制氨气,因为分解后会立刻重新反应;
合成氨反应ΔH<0,是可逆反应
34.关于硝酸
硝酸盐溶液注意氧化性干扰;
避光保存!
浓硝酸遇Fe、Al钝化,易错点和浓硫酸相同;
35.关于化肥(初中内容)
氮肥:尿素CO(NH2)2
;氨水;碳酸氢铵;氯化铵;硝酸铵;硝酸钠……
磷肥:磷酸钙、磷酸二氢钙……
钾肥:草木灰K2CO3;KCl……
复合肥(含有两种及以上):磷酸二氢铵、磷酸二氢钾、硝酸钾……
主要注意:
铵态氮肥和草木灰/碱性化肥合用降低肥效(双水解)
硝酸铵受热或撞击爆炸(结块不能用锤砸)
36.空气污染、温室效应与酸雨
常见的空气污染物:SO2、NO、NO2、O3、粉尘、一些有机物等等CO2不是空气污染物!(不然植物怎么活呢)
常见的温室气体:CO2、CH4(比CO2
造成温室效应能力还强)
导致酸雨的气体:SO2、NO、NO2、CO2
不导致酸雨!
SO2导致酸雨的过程:SO2+H2O H2SO3 ;2H2SO3+O2=2H2SO4
(二氧化硫-三氧化硫-硫酸比较困难,空气中的二氧
化硫在光照和烟尘中的金属氧化物的作用下“也可”被氧化成三氧化硫)
37.关于消毒/净水
常见消毒剂:
“84”消毒液:NaClO,原理是氧化性使蛋白质变性;
过氧乙酸:CH3COOOH,原理是氧化性使蛋白质变性;
75%医用酒精:CH3CH2OH,原理是蛋白质变性,但不是氧化性!
含碘消毒剂:I2,原理是氧化性使蛋白质变性;
苯酚和甲基(邻、间、对)苯酚都可用于消毒;
甲醛使蛋白质变性,用于防止尸体腐烂,一般不用于消毒
常见净水/水消毒剂:
明矾/三价铁:水解原理,利用胶体的吸附性去除一些悬浮杂质;
臭氧/次氯酸钠/二氧化氯/高铁酸钾(K2FeO4)等:利用氧化性,消毒
39.硅和无机非金属材料
易混内容:
含有硅单质:太阳能电池板、芯片(半导体)
含有二氧化硅:沙子、玻璃、石英、玛瑙、光纤
含有硅酸盐:水泥、陶瓷、黏土
以上都属于无机非金属材料
无机非金属材料还包括新型陶瓷,新型陶瓷一般不是硅酸盐,有碳化硅、氮化硼等等
第三节化学与文化
40.课本上的中国“化学名人”及其事迹
按出生时间:
侯德榜:改善氨碱法,创立侯氏制碱法,联合制取纯碱和氯化铵
吴蕴初:在中国创办第一个氯碱厂、味精厂
张青莲:主持测定了多种元素的相对原子质量新值
屠呦呦:发现青蒿素,用乙醚萃取
41.重要外国化学家及其成就(了解)
人 成就
阿伦尼乌斯 电解质的电离模型
波义耳 石蕊指示剂
舍勒 用MnO2(软锰矿)和浓盐酸首次制出了氯气
门捷列夫 元素周期表、预测了一些元素的存在
哈伯 用N2和H2合成氨
盖斯 盖斯定律(热化学方程式加减)
勒夏特列 勒夏特列原理(平衡移动)
伏打 第一个化学电源
玻尔、泡利、洪特 见后
鲍林 电负性、杂化轨道理论
范德华 范德华力
凯库勒 苯的分子结构(不完全正确,他认为是单双键交替)
42.中国与化学有关的成就
青蒿素:见上
合成结晶牛胰岛素:胰岛素是蛋白质,由两条链通过二硫键连接
可燃冰开采:可燃冰是甲烷水合物,不形成氢键用CO2和H2人工合成淀粉:淀粉是多糖,有助于实现“碳中和”,……
43.碳达峰与碳中和
碳达峰:二氧化碳排放量达到峰值
碳中和:通过植树造林,节能减排等行动抵消生产生活等产生的CO2(不是通过中和反应吸收CO2)
不能“什么都往里装”:燃煤脱硫脱硝跟碳达峰碳中和没关系
第四节 化学反应原理
44.关于反应热
注意正负:吸热反应最好也写一个“+”
注意单位:kJ/mol不要漏
热化学方程式注意标!物!态!
一般认为焓变不随温度改变,催化剂不改变反应焓变!
45.常考反应的焓变正负
合成氨反应:放热,ΔH<0;
二氧化氮→四氧化二氮:放热,ΔH<0
HI分解:吸热,ΔH>0
水的电离:吸热,ΔH>0
盐的水解:吸热,ΔH>0
酸碱中和:放热,ΔH<0
46.关于键能
分子中含有双键、三键时,断掉第一根键(σ键)所需能量最大,即多根键的能量不是平均分配的!
断键吸热,成键放热
47.关于反应速率
计算公式:v=Δc/Δt,几点注意事项:
1. 用浓度计算,c=n/V,注意一些题目是“10L容器”
2. 注意时间单位,是min还是s由题目决定
求得的一般是平均速率;
速率可以以不同的物质为标准,注意物质前系数不同,速率也不同;
影响反应速率的因素:浓度(压强)、温度、催化剂、反应物表面积(研磨)、原电池(搭成原电池之后速率更快)
48.化学平衡:理解与判断
平衡不是“停止反应”,而是正逆反应速率相等,达到动态平衡;
49.化学平衡常数
用浓度:和速率一样,注意“10L容器”这类表述!
看准物态:纯固体纯液体不参与!
记得系数要乘方!
只与温度有关,只要温度不变,无论怎么处理,平衡常数一定不变!
*转化率:反应了多少/起初有多少
50.化学平衡:移动
平衡移动与反应速率:升高温度时,无论平衡怎么移动,正逆反应速率都增大,只是增大幅度不同
读题:注意“恒压”还是“恒容”
例:合成氨体系
恒压充He:体积变大,平衡移动
恒容充He:体积不变,反应物生成物浓度不变,平衡不移动(注意N2有时是惰性气体,有时是反应物)
平衡移动不能抵消条件变化:压缩二氧化氮,颜色加深
51.关于水的离子积常数Kw
25℃时:Kw约为1.0×10-14(是常温,不是标准状态!)
(不要和气体摩尔体积22.4L/mol搞混!)
温度越高,Kw越大,故中性不一定pH=7;
(涉及温度变化的题目别忘了Kw也在变化)
52.关于pH
pH=-lgc(H+);(不忘负号,图像题计算注意)
25℃时pH+pOH=14;
给pH问H+物质的量时,注意看有没有给定溶液体积;
工业流程题,计算沉淀所需pH时,记得不要写成pOH
pH试纸:常用的广泛pH试纸酸性红色,中性黄色,碱性蓝色
53.关于指示剂
再过一遍颜色和变色范围:
石蕊:变色区间5~8,酸红色碱蓝色
酚酞:变色区间8.2~10,酸无色碱红色
甲基橙:变色区间3.1~4.4,酸红色碱黄色
指示剂是有机弱酸或弱碱,pH不同,结构不同,颜色不同。
54.关于人体中的酸碱平衡(了解)
重点关注:H2CO3/HCO3-离子对在人体中有稳定pH的作用
55.关于水解
本质:阴离子或阳离子与水电离出来的H+或OH-结合,所以水解促进水的电离(酸或碱的电离抑制水的电离),水解产生的H+或OH-本质上是水电离出
来的;
方程式写可逆号,不标沉淀或气体;
越热越水解,越热越电离;越弱越水解,谁强显谁性
56.水解反应的应用
Al3+、Fe3+均可以水解形成胶体,除去水中悬浮物;
原理(答题模板):使水中细小的悬浮颗粒聚集成较大的颗粒而沉降
泡沫灭火器利用了双水解的原理;TiO2
制备利用了水解原理:TiCl4+(x+2)H2O=TiO2
·xH2O+4HCl
57.沉淀溶解平衡
可逆号!
标物态!
看系数!
用Ksp比较溶解度时,要注意化合物“类型”相同
沉淀转化实验时,前一种沉淀剂要过量
58.电化学装置
基本概念不要混:
原电池:化学能变电能
负极失电子发生氧化反应,正极得电子发生还原反应
电解池:电能变化学能
阳极连正极,失电子发生氧化反应;阴极连负极,得电子发生还原反应
离子移动方向:原电池正正负负,电解池阴阳阳阴;
离子迁移数和转移电子数挂钩;
电子不下水,离子不上岸
59.电化学装置中的pH变化
问×极附近:看电极反应式消耗或生成;
问“一段时间后”:看总反应式和离子迁移
60.电解精炼铜
粗铜在阳极,精铜在阴极;
粗铜中铜前金属进入溶液,铜后金属不进入溶液(控制电压),形成阳极泥(含Pt、Au等贵金属)
转移电子数和阳极消耗的精铜数不挂钩
61.金属的腐蚀与防护
吸氧腐蚀和析氢腐蚀都是电化学腐蚀,主要在钢铁(合金)、铁铆钉的铜板(鲁科版教材情
境)等能形成正负极的情境中发生
不论吸氧腐蚀还是吸氢腐蚀,负极反应都是Fe-2e-=Fe2+;
(电化学腐蚀到+2价,+3价铁的生成和电化学没关系)
教材原文(部编版):实际上,金属腐蚀过程中电化学腐蚀和化学腐蚀往往同时发生,但绝大多数属于电化学腐蚀。电化学腐蚀比化学腐蚀的速率也大得多。
教材原文(鲁科版):在现实生活中,电化学腐蚀现象比化学腐蚀现象更常见。
教材原文(苏教版):电化学腐蚀现象比化学腐蚀现象严重得多……这两种腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀普遍得多,腐蚀速率也大得多。
牺牲阳极法必须用比Fe活泼的金属,如Zn;
镀层破损也能保护,因为形成了原电池!
外加电流法被保护方连接电源负极!
62. 注意原电池作为影响反应速率的因素出现
注意同一个(氧化还原)反应,做成原电池之后反应速率往往进行得更快,
如:用稀硫酸和锌粒制取氢气,滴加几滴CuSO4
溶液可以加快反应速率
第四节 物质结构与性质
63.能层与能级
概念不弄混:
能层是K、L、M、N、…
能级是1s, 2s, 2p, 3s, 3p, 3d,…
K能层包含1s能级
L能层包含2s、2p能级
M能层包含3s、3p、3d能级 ……
64.能级与原子轨道
能级包含原子轨道,电子在原子核外的一个空间运动状态称为一个原子轨道
1s能级:1s原子轨道(球形)
2s能级:2s原子轨道
2p能级:2px、2py、2pz原子轨道(哑铃形,相互垂直) ……(d、f能级的原子轨道不要求)
65.原子排布遵循的各种原理
把原理名称和内容一一对应:
构造原理:指填入能级的顺序:1s,2s,2p,3s,3p,4s,…(能级交错现象)
泡利原理:一个原子轨道里最多只能容纳两个电子,他们的自旋相反
洪特规则:先单独分占,且自旋平行
能量最低原理:构建基态原子时,电子将尽可能地占据能量最低的原子轨道
66.原子结构的各种“式”
以基态O、Cu原子为例
(核外)电子排布式:O:1s22s22p4;
Cu:1s22s22p63s23p63d104s1
(书写顺序不是构造原理填入的顺序,而是能层和能级的顺序;注意Cr、Cu的特例)
简化的电子排布式:O:[He]2s22p4;
Cu:[Ar]3d104s1
最外层电子的排布式(考察频率较低):O:2s2
2p4;
Cu:4s1;
Cu2+:3d9
(“最外层”指有电子且能量最高的能层)
价(层)电子排布式:O:2s22p4;
Cu:3d104s1
(参与成键的电子,s区写s;p区写s、p;d区和ds区写d和s;p区写s和p。
(书后元素周期表)
66.原子结构的各种“式”
以基态O、Cu原子为例
价(层)电子排布图/轨道表示式:画小方格和箭头;问价层就画价层,没说就全画
注意:自旋;标能级名称
66.原子结构的各种“式”
总结:注意读题!
问什么答什么:价层?最外层?整体?
什么物质:基态原子?离子?
有无特例:Cr、Cu
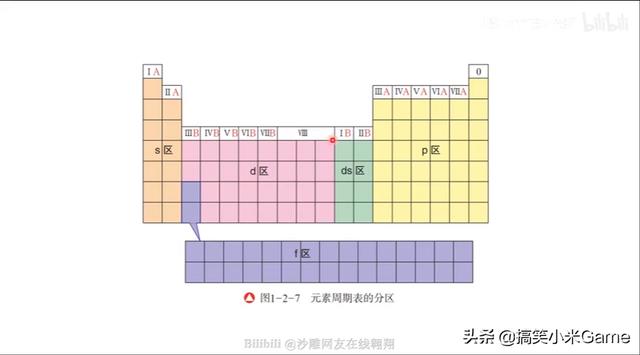
67.元素周期表的结构和分区
容易忽略:ds区(Cu、Zn)s区不全是金属元素(有H)
族的排列顺序:
IA,IIA,IIIB,IVB,VB,VIB,VIIB,
VIII,IB,IIB,IIIA,IVA,VA,VIA,
VIIA,0
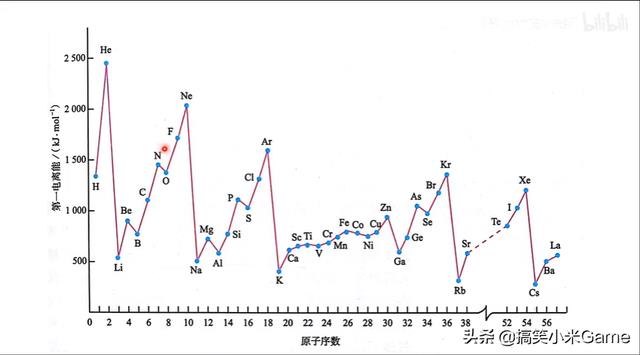
68.第一电离能变化规律与特例
教材出处:部编必修2 P23、鲁科选修2P23-24
特例出现位置与原因:IIA族,VA族,全满/半满稳定
69. 对角线规则
教材出处:部编选修二P22、苏教选修二P43
哪个对角线:左上方-右下方
不是所有的对角线:Li-Mg,Be-Al,B-Si
70.VSEPR:空间结构的标准描述方法
sp杂化:直线形
sp2杂化:平面三角形、V形
sp3杂化:(正)四面体形、三角锥形、V形
注意:是“形”不是“型”;
“正四面体形”和“四面体形”最好区分;
描述用词规范
71.VSEPR:几个概念
中心原子上的价层电子对数:σ键电子对和孤电子对数之和,π键电子对不算
例:CO2中心原子上的价层电子对数:2
孤电子对数:1/2(a-xb),a为中心原子价电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数(H为1,其余为8-价电子数)
VSEPR模型:包含孤电子对(与真实结构不同)
教材出处:部编选修2 P49
Sp:直线形;
sp2平面三角形;
sp3:四面体或正四面体
例:NH3
的空间构型:三角锥形
NH3
的VESPR模型:四面体(CH4
的VSEPR模型是正四面体)
72.范德华力与化学键
范德华力不是化学键,是分子间的作用力,比化学键键能弱1-2个数量级;
相对分子质量越大,范德华力越大;
明确范德华力和化学键键能解释问题的区别:
范德华力一般解释物理变化,如分子晶体的熔沸点差异
化学键键能一般解释化学变化,如HF、HCl、HBr、HI的稳定性差异
73.关于氢键
表示:X-H…Y(X、Y为电负性最大的三种元素:N、O、F)
可以不是直线,但为直线时强度最大;
不是化学键!
氢键影响溶解性但不是唯一因素(答题答全)
74.关于晶体
同一种物质,既可以是晶体也可以是非晶体:
如:SiO2
晶体:水晶
非晶体:玻璃、玛瑙
区分晶体与非晶体:教材出处:选择性必修2 P72
一般方法:看有没有固定的熔点
最可靠的方法:X射线衍射实验
75.关于晶胞
必须是平行六面体(三棱柱形状的一定不是晶胞)
必须能够无隙并置(相邻晶胞无空隙无重叠,所有晶胞平行排列,取向相同)
必须是“最小”(一个晶胞不能再拆出若干个符合上面要求的单元)
“数球”:只数平行四面体范围内的
注意顶角的原子不一定是1/8个球(顶角30°),但一个晶胞所有顶角
的原子加起来一定是1个球
76.晶体密度的计算
公式:M/NAV
M: 晶胞内原子的总相对原子质量
V:注意题目所给的晶胞参数是pm还是nm
1pm=10-12m=10-10cm
1nm=10-9m=10-7cm
注意最终密度单位一般是g/cm3
,注意读题
77.晶体类型
分子晶体:所有非金属氢化物、部分非金属单质(卤素、氧、硫、氮、白磷、C60)、部分非
金属氧化物(CO2、SO2、P4O6、……)
特点:低熔点,硬度小
对性质的解释:范德华力(相对分子质量)
共价晶体:某些单质(金刚石、B、Si、Ge)、某些非金属化合物(SiC)
特点:高熔点,硬度大
对性质的解释:共价键的键能(原子半径),如熔点金刚石>SiC>Si
金属晶体:金属单质
特点:延展性、导电性
离子晶体:盐
特点:硬度较大,熔沸点较高
对性质的解释:离子键(但离子晶体也可以有共价键)(电荷多少,原子半径大小)
78.同素异形体的晶体类型
以C为例:
石墨:混合型晶体(层内共价键,层间范德华力)
金刚石:共价晶体
C60:分子晶体
79.关于配合物
课本实验:[Cu(NH3)4]2+配合物的生成CuSO4
溶液中滴加氨水,现象:先生成沉淀,后沉淀溶解
加入乙醇之后析出晶体,原因:乙醇极性较小,溶解度小
配体必须有孤对电子;
配位数关键看提供几对电子,而不是几个配体;
第五节 有机化学基础
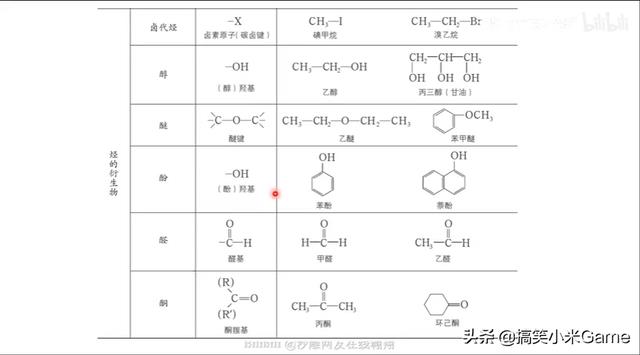
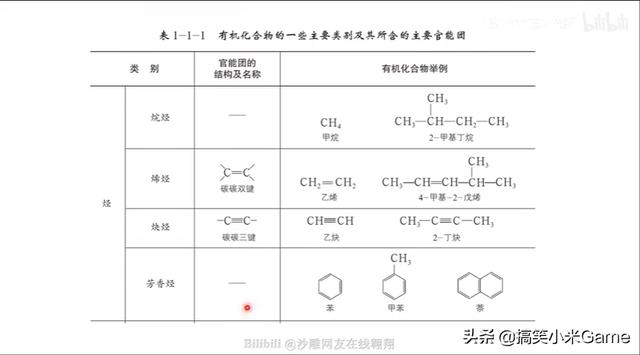
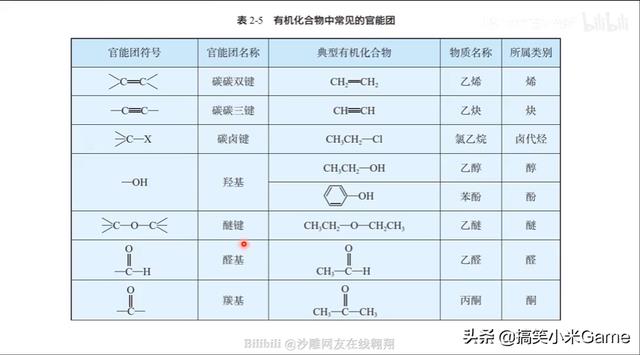
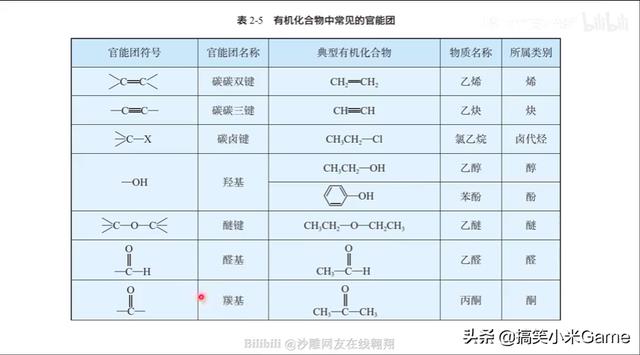
80.新教材中官能团的书写规范
请注意与自己使用的教材和所在地区试卷的要求相匹配!
易错字:羰 羟 醛 酮 羧
81.关于各种“谱”(研究工具)
原子光谱:鉴定元素
质谱:得知相对分子质量
红外光谱:得知化学键和官能团
核磁共振氢谱:得知有几种化学环境相等的氢
X射线衍射:得知更细致的数据(键长、键角……),主要用于晶体
82.关于各种“式”
实验式:最简比!苯的实验式是CH
分子式:首先必须是分子,其次每种元素合并写
(C2H6O是分子式,CH3CH2OH不是)
化学式:离子晶体、分子晶体、原子晶体、金属晶体都能用
83.关于各种模型
球棍模型:有球有棍!教材有时也说“分子结构模型”
空间填充模型:像泡泡一样粘在一起
84.关于同系物
同分异构体不是同系物!
官能团相同是同系物的必要条件:
1-丁烯和环戊烷不是同系物;
1,3-丁二烯和丙炔不是同系物;
官能团相同也不一定是同系物:苯酚和苯甲醇官能团都是羟基,但前者属于
酚,后者属于醇,不是同系物!
85.关于命名
选主链:最长
标号:最小
阿拉伯数字:基团位置
汉字数字:基团有几个
另:“二乙酯”和“乙二酯”的区别:命名之时“醇”换“酯”
86.有机物的密度
在水上层:乙酸乙酯、苯、油脂
在水下层:溴乙烷、四氯化碳
87.苯的卤代
实验时:加入的是铁粉和液溴(不是溴的水/四氯化碳溶液)
实际:起催化作用的是FeBr3
(以溴代为例)
88.苯和取代苯反应的区别
苯:
溴代:必须溴单质,需要催化剂,速率慢;
硝化:生成单取代产物
苯酚:
溴代:溴水就可以,不需催化剂,立刻反应;
甲苯:
硝化:生成三取代产物
体现了:甲基(不是官能团!)和羟基对苯环的活化
89.苯酚的性质
酸性:H2CO3>苯酚>HCO3-,苯酚钠不能和碳酸共存,苯酚不能和碳酸根共存;
可和碳酸钠反应(不生成CO2),和NaOH反应,和Na反应
溶解性:微溶于水,65℃以上与水混溶
体现了:苯环对羟基的活化
90.银镜反应
滴加顺序:向硝酸银溶液中滴加氨水
现象:先沉淀再溶解
产物:乙酸铵、银
可发生银镜反应的物质:醛、甲酸
做完实验之后:用浓硝酸洗掉银镜
91.溴水检验官能团的特例——和醛基反应
92.陌生有机物与NaOH反应的特例
酚羟基、碳卤键、酯基、酰胺基都可以和NaOH反应
特例:一般的酯基碱性条件下水解,1mol酯基消耗1molNaOH;
苯酚形成的酯基,1mol消耗2molNaOH
93.高分子材料的生活应用
塑料:
聚乙烯(做包装袋等),是“热塑性”的,可以反复熔融加工;是加聚反应
的产物;
聚氯乙烯加热分解产生有毒物质,不能用于食品包装
酚醛树脂(做绝缘、隔热、阻燃、复合材料),是“热固性”的,只能一次
成型;是缩聚反应的产物。
合成纤维:与“天然纤维”(棉花等)对应,包括聚酯、聚酰胺等等
合成橡胶:与“天然橡胶”对应,如顺丁橡胶(1,4-加成的产物)
可降解高分子:如聚乳酸
“新型”:如聚丙烯酸钠,吸水性强,可做“尿不湿”
*不粘锅是聚四氟乙烯
94.煤和石油的综合利用
煤:
干馏:化学变化,隔绝空气加强热,得焦炭、煤焦油和煤气等
气化:化学变化,转化为CO、H2
等
液化:化学变化,“煤制油”,转化为液态的烃
石油:
分馏:物理变化,相当于蒸馏,得汽油、煤油、柴油、沥青等
裂解/裂化:化学变化,将长链烃变为短链烃
催化重整:化学变化,链状烃转化为环状烃,芳香烃的重要来源
*“水煤气”是水蒸气高温下通过焦炭得到的气体,主要是CO和H2的混合气
95.生活中常见的一些有机化合物
味精:谷氨酸钠
食品防腐剂:苯甲酸钠、山梨酸钾)、*亚硝酸钠(不是完全不能加,可以按标准加一点点)
抗氧化剂:维生素C(具有还原性!水溶液中或受热容易被氧化)
阿司匹林:乙酰水杨酸(邻羟基苯甲酸乙酯)
*关于维生素:
脂溶性:A、D、E、K;
水溶性:C、B族
96.关于糖类
单糖:葡萄糖能发生银镜反应、与氢氧化铜反应,属于醛糖;
果糖属于酮糖;
单糖都不能发生水解反应;
二糖:蔗糖=葡萄糖+果糖,不是还原糖
麦芽糖=2×葡萄糖,是还原糖
都可以水解(酸性环境或酶)
多糖:淀粉和纤维素都是葡萄糖单元相互连接而成
淀粉和纤维素不是同分异构体!
都属于非还原糖,都可以水解(酸性环境或酶)
97.关于油脂
油脂:高级脂肪酸与甘油(丙三醇)形成的酯
饱和脂肪酸:脂肪酸的碳链是烷基链
不饱和脂肪酸:碳链上有双键(可以氢化加成掉)
液态是“油”,固态是“脂”
油酸是不饱和脂肪酸(C17H33COOH),硬脂酸是饱和脂肪酸
(C17H35COOH)
油脂在碱性条件下的水解反应又称为皂化反应;
油脂可以催化加氢(“氢化植物油”)由液态变为半固态(人造奶油)
98.关于蛋白质
氨基酸具有两性:能和酸、碱反应生成盐
两种氨基酸可以形成4种二肽,不同二肽可以得相同的水解产物
水解:条件为酸、碱或酶
盐析:某些盐(不是重金属盐,如硫酸钠、硫酸铵、氯化钠)能促进蛋白质溶解,
盐浓度增大到一定程度时,蛋白质溶解度又降低从而析出是可逆过程,不影响活性
变性:重金属盐(如硫酸铅)、强酸碱、甲醛、乙醇、加热、射线、…不可逆,影响活性
(误服重金属盐溶液,应服用大量牛奶)
显色:含有苯环的蛋白质与浓硝酸生成白色沉淀,加热后变黄色
鉴别:灼烧,有烧焦羽毛气味
99.关于氨基酸的存在形式

100.核酸
教材出处:部编选修3 P119、鲁科选修3P83
描述:
磷酸、戊糖和碱基通过一定方式结合而成的生物大分子
101.生物大分子
淀粉、纤维素、蛋白质、核酸是生物大分子,也属于高分子
脂肪不是生物大分子,更不是高分子
*棉麻(植物)主要是纤维素(C、H、O),丝绸羊毛头发(动物)主要是蛋
白质(C、H、O、N、S)
第六节 化学实验
102.常见易错仪器名称
容量瓶 坩埚(注意偏旁) 坩埚钳 长颈漏斗 分液漏斗
蒸发皿 干燥管 蒸馏烧瓶 三脚架 泥三角(不是三脚架)
表面皿(和蒸发皿区分) 球形冷凝管 直形冷凝管 三颈烧瓶
圆底烧瓶 锥形瓶 烧杯 胶头滴管 试管夹
45:15 · 不方便截图,自己点传送门
103.配制溶液
一定质量分数的溶液:不用容量瓶,用量筒和天平
一定物质的量浓度的溶液:用容量瓶、天平、烧杯、玻璃棒、胶头滴管
先在烧杯中溶解,然后转移(玻璃棒引流)
蒸馏水洗涤烧杯和玻璃棒两到三次,洗涤液也转移(防止损耗)
最后定容时用胶头滴管滴加
定容之后才能盖盖,然后上下颠倒摇匀
容量瓶不能加热!
104.物质检验时的注意事项
用BaCl2
检验硫酸根:排除SO32-、Ag+的影响(先用盐酸酸化,探路);
用AgNO3
检验氯离子:排除CO3
2-的影响(先用硝酸酸化); ……
体系中有HCl时,不能用KMnO4
检验还原性微粒; ……
Ca(OH)2不能区分NaHCO3和Na2CO3
105.无机化学制备实验中的洗气
制备氯气:洗HCl,用饱和食盐水;
制备SO2:洗硫酸酸雾,用饱和NaHSO3
溶液;
制备CO2:洗盐酸(挥发),用饱和NaHCO3
溶液
106.课内有机化学实验中的注意事项
用乙醇制备乙烯:杂质主要是乙醇、二氧化硫
温度计伸到液体中,量程要大于170℃
用溴乙烷制备乙烯:杂质主要是溴化氢(用水洗)
用电石制备乙炔:杂质主要是硫化氢、磷化氢,用硫酸铜溶液洗
用饱和食盐水反应,控制反应速率
酯化反应:用饱和Na2CO3溶液吸收,导管不伸入
107.课内探究实验中的注意事项
排除溶液挥发性的干扰:右图
加少量还是加过量:沉淀溶解平衡的探究
控制变量:一组加试剂,另一组加蒸馏水;
FeCl3和Fe2(SO4)3
在同一个实验中应用,要注意什么?
选择恰当的变量:用酸性高锰酸钾和草酸的反应探究浓度
对反应速率的影响,控制谁的浓度不变?(高锰酸钾,不然褪色速度无可比性)
排除干扰:密切关注NO3-等离子(氧化性干扰)
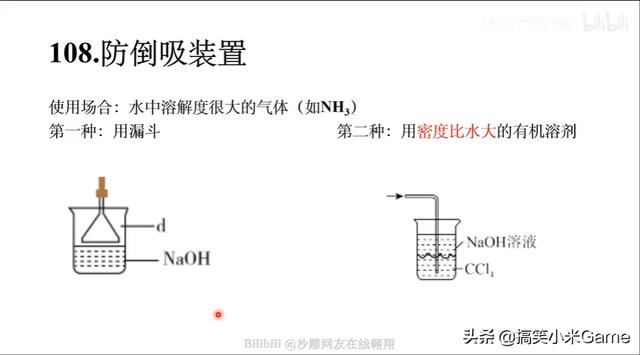
108.防倒吸装置
使用场合:水中溶解度很大的气体(如NH3)
第一种:用漏斗
第二种:用密度比水大的有机溶剂
(个人刷到过使用干燥管防倒吸的题目)
109.物质分离——过滤
主要用具:漏斗、玻璃棒、烧杯

110.物质分离——蒸馏
适用:沸点相差较大
温度计玻璃球位置:蒸馏烧瓶的支管口附近,不伸入;
冷凝管中,冷凝水下进上出;
111.物质分离——萃取分液
仪器:分液漏斗
操作:装置放置正确(右图)
“上吐下泻”:上层从上面口出,下层从下面口出
反萃取:达到富集的作用

112.滴定实验
读题注意:
是直接滴定还是返滴定(滴过量的部分)?
什么物质参加了反应?有没有干扰?
谁滴定谁?
什么物质充当指示剂?
(经典的指示剂,如酚酞;自己做指示剂,如高锰酸钾;不太熟悉的指示剂,如碘化银,……)
112.滴定实验
装置注意:
酸式滴定管:玻璃头(高锰酸钾也装酸式滴定管)
碱式滴定管:橡胶头
滴定管的刻度:0在最上端,实际盛装液体量大于量程
计算注意:单位(浓度一般是mol/L,而体积一般是mL)
题目问的是什么单位(mol/L?g? g/L? mg/L? %?)
系数比不弄反
化学式内部的系数(例如H2C2O4有两个碳)
答题注意:
滴定终点的描述(答题模板):
滴入最后一滴/半滴××溶液后,(现象)(颜色由×色变为×色;生成×沉
淀),且震荡30s现象不消失(颜色不褪色;沉淀不溶解,等等)
误差分析:
以列出来的等式为依据,逐步分析就不容易错
第七节 具体答题注意
113.易错无机方程式
条件易错:要注明条件的注明条件
铁和水蒸气反应:高温
铝热反应:高温
电解法制金属单质(钠、镁、铝):电解/通电NH3
催化氧化(“4546”):催化剂,加热
SO2氧化为SO3:催化剂,加热
合成氨:高温高压催化剂
电解氧化铝:熔融电解冰晶石
113.易错无机方程式
一些特殊标记:
浓硫酸、浓盐酸、浓硝酸标记(浓)
铁与水蒸气反应,标明气体(g)
电解熔融盐标记“熔融”
热化学方程式、沉淀溶解平衡统统标物态(s)(l)(g(aq)
113.易错无机方程式
可逆符号:
氯气溶于水可逆;
合成氨反应可逆;
二氧化氮与四氧化二氮转化可逆;
二氧化碳二氧化硫转化成对应含氧酸可逆;
二氧化硫氧化为三氧化硫可逆;
碘离子和碘单质反应可逆;
水解反应可逆;
弱酸弱碱电离可逆;
难溶物沉溶平衡可逆
114.易错有机方程式
小分子产物不要漏:水、盐、等等
注意生成物酸碱性与环境匹配:
溴乙烷和氢氧化钠水溶液反应生成溴化钠(不是溴化氢)
酰胺酸性水解生成铵盐,碱性生成氨气
注意条件:
乙醇脱水:浓硫酸,170℃(唯一写明温度的反应条件)
硝化反应,酯化反应:浓硫酸写箭头上面,加热
加成反应:一般催化剂加热
乙醇氧化成乙醛:Cu/加热
烷烃取代:光照
注意可逆:
酯化反应可逆(酯化反应四大易错点:可逆、浓硫酸、加热、小分子)
酯的酸性水解可逆(箭头上下写稀硫酸,加热)
115.陌生无机方程式书写要点
1. 配平正确
2. 酸碱环境符合题目要求(H+,OH-,以及Fe2+、Fe3+、NH4+等对酸碱环境有要求的物质)
3. 反应物、产物中有没有不能共存的离子(Al(OH)3
和OH-,等等)
4. 拆与不拆(草酸不拆,……)
5. 少量与过量
6. 题目中的其它提示(关于pH、现象等等)
7. 条件(读题干,加热、高温、光照一类)
116.陌生有机方程式书写要点
1. 配平特别注意聚合反应方程式有n小分子的系数一般为“n-1”“2n-1”一类
2. 酸碱环境(重点关注羧基、酚羟基)
3. 条件(课内学过?参考资料中给出了条件?)
117.书写规范
别让错别字阻止你得分:
羟 羰 醛 酮 酯 坩埚 氮 熔融 焓 碳元素 木炭
其它书写规范:
缩聚反应产物要封端;
有机结构式画整齐;
写HO-CH2CH3而不是OHCH2CH3;
写多少族,注意用罗马数字,不写错:IV是4,VI是6
区分汉字数字和阿拉伯数字:第三周期 +1价 ……
118.答题全面
工业流程题等题型,有些时候一道题答案有好几条,如:
××步骤中反应的方程式?
除了主要进行的反应外,往往会有一个H++OH-=H2O这类简单但不易察觉的方程式
××体系中的阳离子/阴离子/沉淀主要有?
往往有多种物质,记得答全
××操作的目的?
写完显而易见的目的之后再回去看看,可能还有第二个目的
119.角度准确
关注题目信息的给出方式,如
相同时间内的转化率:从速率角度作答
平衡转化率:从平衡角度作答
关注题目给出的信息内容,如
陌生参考资料有一条完全没有用到,很有可能是某一问漏了要点
关注设问方式(直接提醒)如:
从平衡移动角度分析:存在××平衡,××浓度变化,平衡正向/逆向移动,结果××××
从氧化还原角度分析:××物质浓度增大/减小,氧化/还原性增强/减弱,结果××××
从结构角度分析:位(元素周期表)-构(半径、电子层数、…)-性
书写工整,空间不紧迫时,字间距大一些
120.不“想当然”
现在高考的特点是“去模式化”“创新性”,看到自己特别熟悉的情境或者问法的时候,别太高兴激动,不急着背口诀,求“秒杀”,仔细读读题干,看看和自己平时练过的有什么相同或不同,有不同的,题干信息优先;
许多探究类题型都是对课本常见情境的再认识,探究出来的结果不一定就是课上讲过的简单的结论,仔细分析现象之后再作答
121.读题仔细
读题要点举例:
大题题干不能跳:目的是什么?要制备什么东西?制备的东西是干什么用的(有时候隐含着陌生物质的性质)
小题题干找关键:酸碱环境?条件?要我根据哪个图表得出结论?
小题读完再填空:括号后面写的是什么?(大多提示反应的现象,等等)
有机大题,小题题干中的字母和合成路线中的字母对照一下,避免答非所问
其它信息:
单位,不变量,…图表的横轴、纵轴、图例;
122.勤于动笔
圈点勾画题干中关键信息;
不确定的题用自己熟悉的符号在试卷(不是答题卡)上标出来,回来优先检查;
工业流程题,起始体系中的离子全写出来,一步一步划掉,不容易漏;
有机推断题,推出来的结构简式铅笔写旁边,不容易抄错;
选择题,选项说法对就打“√”,错就打“×”,有的同学喜欢根据符合题干
与否写符号,题干问错误选项,就在错误选项打“√”,正确选项打“×”,
回来检查时,容易把自己绕进去;
123.善于检查
客观题填涂:
试卷上写的ABCD和答题卡涂的ABCD,题号,选项是否一致?
试卷上写的ABCD和选项上做的标记是否一致?(避免“想选B手上写C”的情况)
主观题检查
是否漏题?(尤其是补充图中信息的问题)
问答是否一致?(问G的结构写了F的结构)
完结撒花!

相关参考
...:气体(2)使用条件:同温、同压、同体积(3)特例:标准状况下的气体摩尔体积(Vm=22.4L/mol)2,质量守恒定律:参加反应的各物质质量总和等于反应后生成物的质量总和(或反应前后各原子的种类及个数相同)。质量守恒定...
...:气体(2)使用条件:同温、同压、同体积(3)特例:标准状况下的气体摩尔体积(Vm=22.4L/mol)2,质量守恒定律:参加反应的各物质质量总和等于反应后生成物的质量总和(或反应前后各原子的种类及个数相同)。质量守恒定...
标况下气体体积计算公式(人教版新教材高一化学 第二章气体摩尔体积课后练习)
...1.设NA为阿伏加德罗常数的值,下列说法正确的是()①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA②同温同压下,体积相同的氢气和氩气所含的分子数相等③1L2mol/L的氯化镁溶液中含氯离子为4NA④标准状况...
在学习高中化学中,有许多同学感到化学计算比较难而且零零碎碎,真不知道究竟有些啥,今天我们就仔细地盘点一下。一、有关围绕物质的量的计算(必修一册),我认为这是高中化学计算的核心,必须掌握好。学习时,必须...
1水和水的溶液1.1地球上的水1.1.1水的分布1.地球上水的总贮量约有1.386×1018米3,其中约96.53%为海洋咸水,0.94%是陆地咸水,地球上的淡水(陆地淡水和大气水)仅占总水量的2.53%。2.陆地淡水包括冰川水、地下淡水、湖泊淡水、...
...与提纯过程的简单设计。 5.物质的量及其单位——摩尔。 6.阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量浓度等概念。 7.有关物质的量、微观粒子数、质量、体积、物质的量浓度等之间转化的计算。 ...
...分离与提纯过程的简单设计。5.物质的量及其单位——摩尔。6.阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量浓度等概念。7.有关物质的量、微观粒子数、质量、体积、物质的量浓度等之间转化的计算。8.一定物质...
...分离与提纯过程的简单设计。5.物质的量及其单位——摩尔。6.阿伏加德罗常数、摩尔质量、气体摩尔体积、物质的量浓度等概念。7.有关物质的量、微观粒子数、质量、体积、物质的量浓度等之间转化的计算。8.一定物质...
气体可以均匀地填充任何大小或形状的容器。气体是一种没有固定形状和体积的物质状态气体是一种物质状态,没有固定的形状,也没有固定的体积。气体的密度比其他物质的密度低,如固体和液体。粒子之间有很大的空间,它...
常用的在线分析仪表(仪表工试题——中石化在线分析仪表技术比武试题11)
2、按照《工业卫生标准》规定,工作场所空气有害物质容许浓度:一氧化碳:30mg/m3、氯气:1mg/m3、硫化氢:10mg/m3。已知:按理想气体计算,20℃、101.325kPa下1摩尔气体的体积取24升,各元素原子量:O:16;C:12;CL:35.5;S:32:...