柠檬酸异丙(动物源性食品中兽药残留的检测——硝基咪唑类药物残留)
Posted
篇首语:聪明在于勤奋,天才在于积累。本文由小常识网(cha138.com)小编为大家整理,主要介绍了柠檬酸异丙(动物源性食品中兽药残留的检测——硝基咪唑类药物残留)相关的知识,希望对你有一定的参考价值。
柠檬酸异丙(动物源性食品中兽药残留的检测——硝基咪唑类药物残留)
硝基咪唑类药物(nitroimidazoles,NIIMs)是一类具有5-硝基咪唑环结构的杂环化合物。自20世纪50年代以来,人工合成的NIIMs在抗菌和抗原虫方面得到广泛应用,尤其对厌氧菌有强大的杀灭作用,是治疗厌氧菌感染的首选药物之一。因该类药物及其代谢物对哺乳动物具有致癌、致畸、致突变作用和遗传毒性,许多国家均禁止其在动物源性食品中使用。但由于其具有显著的临床治疗效果和防病促生长作用及廉价易得的特点,目前畜牧业养殖中仍有非法使用NIIMs的情况。常见的NIIMs主要有甲硝唑(metronidazole,MNZ)、地美硝唑(二甲硝咪唑,dimetridazole,DMZ)、异丙硝唑(ipronidazole,IPZ)、洛
硝基咪唑类药物(nitroimidazoles,NIIMs)是一类具有5-硝基咪唑环结构的杂环化合物。自20世纪50年代以来,人工合成的NIIMs在抗菌和抗原虫方面得到广泛应用,尤其对厌氧菌有强大的杀灭作用,是治疗厌氧菌感染的首选药物之一。因该类药物及其代谢物对哺乳动物具有致癌、致畸、致突变作用和遗传毒性,许多国家均禁止其在动物源性食品中使用。但由于其具有显著的临床治疗效果和防病促生长作用及廉价易得的特点,目前畜牧业养殖中仍有非法使用NIIMs的情况。常见的NIIMs主要有甲硝唑(metronidazole,MNZ)、地美硝唑(二甲硝咪唑,dimetridazole,DMZ)、异丙硝唑(ipronidazole,IPZ)、洛硝哒唑(ronidazole,RNZ)、塞克硝唑(secnidazole,SNZ)及替硝唑(tinidazole,TNZ)。本部分综述了NIIMs的理化性质、药理与毒理学、国内外限量要求以及残留检测的样品前处理、仪器测定方法等内容,以期为该类药物的全面了解和残留检测提供参考。
1 理化性质
NIIMs为白色或淡黄色结晶或结晶粉末,弱碱性、中等极性化合物,能和酸结合成盐,遇光易分解,易溶于甲醇,微溶于水。
MNZ化学名称为2-甲基-5-硝基咪唑-1-乙醇,为白色或微黄色结晶或结晶粉末。有微臭,味苦而略咸。在乙醇中略溶,在水或氯仿中微溶,在乙醚中极微溶解。
DMZ为类白色至微黄色粉末,无臭,遇光色渐变深,遇热升华。在氯仿中易溶,在乙醇中溶解,在水或乙醇中微溶。
NIIMs在动物体内通过C2侧链的氧化而被快速代谢,代谢物与原药具有相似的潜在毒性。DMZ、IPZ、MNZ分别代谢为HMMNI(即DMZOH)、IPZOH、MNZOH;RNZ代谢产物中仅有少部分含咪唑环,其结构与HMMNI相同。NIIMs分子结构、常见特性及代谢产物结构见图5-48。
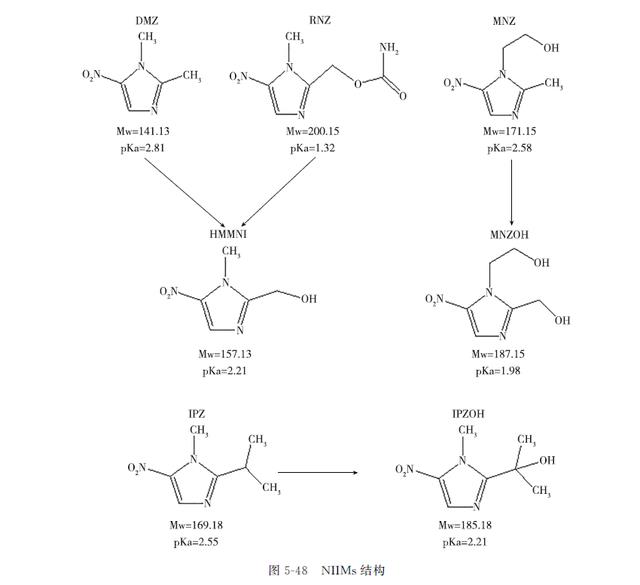
2-羟甲基-1-5-硝基咪唑(HMMNI)是DMZ的主要代谢物,具有NIIMs的基本结构,在残留检测中需要与原型药物同时测定。MNZ、RNZ、TNZ、DMZ及它们的代谢物性质相近,采用HPLC法同时分离检测十分困难,早期报道的检测方法大多是测定单一药物或两种原型药物与其代谢物,我国目前应用的动物源性食品中NIIMs残留检测HPLC法存在未能同时测定其代谢物或前处理步骤繁琐等问题。
2 药理学
NIIMs主要用于治疗原虫感染,如牛毛滴虫病、犬贾第虫病、鸡和火鸡的组织滴虫病、禽贾第虫病、急性阿米巴痢疾和肠外阿米巴病;用于预防和治疗猪的出血性腹泻及厌氧菌感染。此外该类药物也可促进动物生长和提高饲料利用率。
许多文献报道该类药物及其某些代谢物对哺乳动物具有致癌、致畸、致突变作用和遗传毒性,这是由于其代谢物中同样含有引起毒性的硝基咪唑环,因此NIIMs残留检测目标化合物应该包括母药及其代谢物。
(1)MNZ 口服吸收良好,生物利用度可达90%~100%,血浆蛋白结合率为10%~20%。有效血药浓度可维持12h,血浆半衰期为8~14h,在体内分布广,药物在胎盘、乳汁及胆汁中的浓度均可达到与血药浓度相仿水平。脑膜无炎症时脑脊液药物浓度为同期血药浓度的43%,脑膜有炎症时脑脊液药物浓度可达血药浓度的90%以上。MNZ具有强大的杀灭滴虫作用,但不影响阴道正常菌群生长,故为治疗阴道滴虫病的首选药物;还对组织内及肠腔内阿米巴滋养体有杀灭作用,对革兰氏阴性和阳性厌氧菌均有抑制作用,该药对需氧菌无效。MNZ抗厌氧菌的作用机制是该药的硝基可被厌氧菌还原产生细胞毒物质,抑制了敏感菌DNA合成,使细菌死亡。主要用于治疗厌氧菌感染,包括由厌氧菌引起的产后盆腔感染、肺脓肿、胸膜感染、败血症、骨髓炎、脓毒性关节炎、气性坏疽等。还可用于防治阑尾、结肠、产科手术感染。MNZ除了抗滴虫及阿米巴原虫外,还对脆弱拟杆菌、黑色素拟杆菌、梭状杆菌属、产气荚膜梭状芽孢杆菌等有良好抗菌作用。
(2)TNZ TNZ是继MNZ后研制成的疗效高、疗程短、半衰期长、耐受性好的抗滴虫及抗厌氧菌药物,抗菌作用与MNZ相似,副作用少,与其他抗生素联合应用于各个领域。如TNZ(0.5mg,2次/d)联合奥美拉唑(20mg,1次/d)和甲基红霉素(0.25mg,2次/d)使用1周,可有效地清除幽门螺杆菌。MNZ和TNZ对引起牙周及口腔颌面部感染的常见菌牙龈卟啉单胞菌均敏感,MNZ最低抑菌浓度(MIC)为<0.25mg/L,TNZMIC为<0.06mg/L,表明TNZ的抗菌作用优于MNZ。近年来,为避免药物的全身不良反应,陆续出现了许多TNZ与其他抗生素配伍的外用制剂,如与硝酸咪康唑、泼尼松、氧氟沙星制成膜剂,用于治疗冠周炎、牙周炎、口腔溃疡等口腔疾病;与环丙沙星制成复方替硝唑栓,用于治疗慢性盆腔炎等。
3 毒理学
NIIMs药效基团为硝基,硝基的还原不仅是药理作用产生的基础,也是毒性产生的主要原因。Voogd的试验发现此类药物对真核细胞(包括哺乳类动物细胞)可能有弱的诱变作用。Mohindra对中国田鼠卵巢细胞在低氧及有氧条件下生存力的研究结果显示,增殖期细胞在低氧条件下对药物的毒性极其敏感。另外硝基为亲电子基团,易与谷胱甘肽(GSH)结合,从而使体内GSH浓度显著下降,当其浓度下降到一定水平时出现毒性反应。
(1)MNZ 在应用MNZ治疗阴道滴虫病过程中发现,若MNZ每日用量大于2g,应用1~2周常产生明显的副作用,包括恶心、呕吐、口腔金属异味、头痛、感觉障碍;若MNZ每日用量大于3g,连续应用超过5d,即可出现外周神经毒性。有报道称MNZ还可引起精神症状、尿道刺激症状及心律失常,但均少见。
(2)TNZ 在毒性试验中发现,TNZ可诱发肺炎克氏柠檬酸菌、大肠杆菌K12突变,对中国仓鼠V79肺细胞无致突变性,对鼠仔无致畸作用。在对多地区进行的因口腔炎症应用TNZ治疗病人的Ⅱ期临床试验研究中,排除孕妇、哺乳期妇女、严重神经系统疾患、血液病及严重肝、肾功能损害或对NIIMs过敏者,约1/3病人出现不良反应。消化道不良反应表现为恶心、胃痛、厌食、口腔金属异味、呕吐及腹泻,神经系统不良反应表现为头昏、头痛、眩晕以及谵妄、多言等症状,部分出现过敏反应及轻度白细胞减少。消化道不良反应多见于第1天用药时,常在用药后半小时至数小时发生,精神系统不良反应一般在用药7~12h发生。另外,TNZ可致血压升高,高血压病人应慎用,其发生原因尚不清楚。
4 国内外限量要求
由于该类化合物具有细胞诱变性、动物致癌毒性等潜在严重危害性的问题,美国、欧盟以及日本等国家和组织早已将其列入动物源性食品中禁止使用化合物清单。2002年美国FDA公布了禁止在进口动物源性食品中使用的11种药物,其中包括DMZ及其他NIIMs。欧盟禁止NIIMs用于食品动物。欧盟法规2377/90的附录Ⅳ将NIIMs列为动物源性食品中不得检出的药物;RNZ、DMZ、MNZ相继在1993年、1995年、1998年被禁止用于食品动物,并且未批准IPZ作为兽药使用。其中,DMZ于1995年被禁止作为兽药使用,但仍可作为饲料添加剂,但2001年11月,欧盟规定禁止DMZ在饲料中作为添加剂使用。加拿大相继于2003年取消所有NIIMs作为兽药在食品动物中的使用。2002年3月,我国也开始对NIIMs进行严格控制,农牧发〔2002〕1号文件的禁用兽药清单中包括DMZ、MNZ和RNZ。《无公害农产品兽药使用准则》(NY5030—2016)和《绿色食品兽药使用准则》(NY/T472—2013)均规定了禁止以促生长为目的在所有食品动物中使用MNZ、DMZ及其盐、酯与制剂。对饲料中NIIMs的不合理添加而造成的可食性动物组织中药物残留问题受到世界各国的普遍关注。
因此有必要建立一种可靠灵敏的检测痕量水平NIIMs残留的检测方法。由于NIIMs缺乏MRL或残留检测参考限量,欧盟残留基准实验室建立了参考浓度,以指导所有基准实验室检测和确定NIIMs残留。这些参考限量不是法律规定,只是确立了分析方法需要达到的最低要求,NIIMs在所有基质中参考浓度为3μg/kg(或μg/L)(IPZ、IPZOH除外,因IPZ未被批准作为兽药使用)。
5 样品前处理方法
样品前处理目的是分离和浓缩基质中的药物使其易于分析和检测,已逐渐成为分析方法的主要环节和步骤,通常占据整个分析时间的70%~80%。样品检测包括取样、提取、净化、检测和结果分析等5个环节,其中样品前处理(取样、提取、净化)的好坏是分析结果准确与否的关键。
5.1 取样
取样环节的影响至关重要,尤其对NIIMs这类不稳定的药物残留影响很大。需要注意两个主要因素:基质种类和运输、储存时的温度。正确的取样方法应避免药物损失、提高药物含量稳定性和确保取样完整性。由于NIIMs原药及其代谢物在非冷冻条件下降解迅速,因此取样后应立即进行前处理或冷冻保存。Polzer等通过研究火鸡中NIIMs残留稳定性和均质性发现,热应激对NIIMs含量有很大影响。快速冷冻样品中NIIMs残留量高,室温保存几小时的样品药物很快降解。样品中RNZ在室温和4℃保存,损失均高达91%。由此说明NIIMs在采样过程中和非冷冻储藏时均会快速降解。但血浆和视网膜中药物含量稳定,即使停药一段时间后仍可测得较为恒定的浓度,且与采样过程和储藏条件无关。因此确定血浆和视网膜是检测样品中NIIMs残留的靶组织。
对药物在基质中分布的研究表明,NIIMs原药及其代谢物在肝脏和肌肉中非均质分布,推荐用冻干法处理样品以获得药物均质分布的样品,而在血浆和视网膜中药物不仅含量稳定,而且分布均匀。
5.2 提取
生物样品成分复杂,包括蛋白质、盐类、酸、碱和与待测物性质相似的有机化合物。而且,分析物在样品中的含量通常很低,大多分析仪器不能直接检测样品,因此需对样品进行提取,以分离和浓缩目标分析物。
通常用乙酸乙酯、乙腈或者甲苯、二氯甲烷等有机溶剂提取生物样品中的NIIMs。乙酸乙酯是常用提取溶剂,尤其在分析肌肉样品时。由于乙酸乙酯提取鸡蛋样品时易乳化,影响基质中药物提取,因此乙腈常用于鸡蛋中NIIMs提取。
提取过程中常加入一些辅助试剂以除去杂质。常用正己烷除脂,还可加入氯化钠盐析,促进有机相和水相明显分层。Cronly等用正己烷和氯化钠提取鸡蛋和血浆中的NIIMs。
提取后要将提取液氮吹至近干以除去提取溶剂,但氮吹过程中温度过高和吹得过干可能导致药物损失。乙酸乙酯沸点较低,因此适于做提取溶剂以方便浓缩。在提取液中加入少量低挥发度溶剂如乙二醇(沸点241℃),以防止蒸发温度超过40℃。Ho等通过比较在洗脱液中加DMF、TFA、乙酸和在不同温度下(25℃、40℃)氮吹,发现25℃和加TFA能提高回收率。
大多NIIMs测定的方法中需提取两次以满足回收率要求,而Cronly等比较了一次提取和两次提取血浆和鸡蛋中NIIMs残留的回收率,结果表明两次提取的药物回收率提高不多(5%~7%)。但是,即使采用一次提取也不足以提高样品检测的高通量。
提取过程中调整pH可提高回收率。Ding等将样品用氢氧化钠(0.25mol/L)溶解后,用乙酸乙酯提取,回收率提高10%~60%。Hurtaud-Pessel等研究表明HMMNI和RNZ在碱性条件下易溶于有机溶剂。K2HPO4的缓冲溶液常用作提取液的碱化试剂。
在应用色谱-质谱联用技术时,由于质谱的选择性和特异性强,在一些已报道的方法中提取液经过简单的液-液萃取(LLE)后,即可进样分析。
5.3 固相萃取(SPE)
生物样品提取液中含有包括分析物在内的许多化合物,大多数净化手段需要运用SPE,SPE的选择包括C18柱、硅胶柱和离子交换柱等。
Polzer等用ExtrelutNT20和XTR柱分别提取鸡肉、血浆和视网膜中的NIIMs。Oasis HLB是一种亲水亲脂的聚合物吸附剂SPE柱,在提取、浓缩NIIMs及其代谢物的分析中较为常用,适用的动物基质包括新鲜鸡蛋和其他鸡蛋制品、猪肉、猪肝和其他猪可食组织。
还有报道使用氨基柱净化提取液。氨基柱和硅胶柱作用机理相似,分别为氨基和硅醇基与药物的咪唑环部分通过极性相互作用而吸附。优化SPE条件时发现样品基质中微量的水对方法精密度和重现性有显著影响,因为水分子可与SPE的氨基基团相互作用。因此在提取液和SPE柱上一般加入足量的无水硫酸钠以吸收提取液中的水分。另外,提取液中加入正己烷等非极性溶剂,可以防止分析物穿漏,保证回收率。
SCX柱属于离子交换SPE柱,其原理是离子化的NIIMs与SCX柱上苯磺酸基团的离子相互作用而保留在柱子上。由于离子相互作用强于非极性相互作用,所以用强洗脱能力的非极性溶剂淋洗以加强净化效果。SCX对NIIMs的吸附能力强于C18柱和硅胶柱。近年来,结合强阳离子交换和反相相互作用的混合型SPE(Oasis MCX)得到了广泛应用。在亲水亲脂平衡的基础上,MCX在聚合物吸附剂表面键合了磺酸基团以提供反相和强阳离子交换功能,以净化提取猪肝、猪肾和猪尿中的NIIMs。
5.4 免疫分子印迹(MIP)
将印迹分子加入与之发生化学作用的功能单体中,然后加入交联剂、引发剂等进行聚合反应,形成以高度交联的固态高分子,即分子印迹聚合物。该聚合物可选择性富集目标分析物。印迹聚合物由于既可在有机溶剂中使用,又可在水溶液中使用,故与其他萃取过程相比具有独特的优点。印迹聚合物与印迹分子之间作用的强度与选择性在一定程度上可以和抗原与抗体之间的作用相媲美。
Mohamed等建立了MIP-SPE方法选择性提取鸡蛋粉末中4种NIIMs及3种代谢物,用LC-ESI-MS/MS检测、内标法定量。称取2.5g鸡蛋粉加入10mL水和10mL乙腈提取,4000g离心15min,上清液转至含有2g氯化钠的离心管中,涡动后离心,取上清液于50℃氮吹至干,用2mL水复溶,超声后转至MIP-SPE上。MIP-SPE依次用1mL的甲苯、乙腈、水活化后上样,接着用1mL水、2次1mL正己烷淋洗,2mL0.5%醋酸乙腈-水(60∶40,V/V)洗脱液洗脱,50℃氮吹至干,500μL水复溶,超声后过膜,进行LC-MS/MS分析。
6 检测方法
目前测定食品中NIIMs的残留分析方法有筛选方法和定量确证方法。筛选方法包括ELISA、光学感受器等,而定量确证方法大多是基于色谱分离及其联用技术。
早期研究仅针对一种或两种NIIMs。近年来一些NIIMs多残留测定方法相继被报道。Sun等测定了鸡肉和猪肉中7种NIIMs,Cronly等研究的方法分别可以测定血浆和鸡蛋中10种以上NIIMs。分光光度法、电泳法、薄层色谱法(TLC)均被报道过用于NIIMs的检测,但是最常用的方法是色谱法,大多为气相色谱法(GC)和液相色谱法(LC)配紫外检测。由于NIIMs被禁止使用,这对检测的灵敏度和确证有了严格要求,检测技术也逐渐由GC、HPLC、TLC发展为色谱-质谱联用的方法。相比较而言,GC-MS需要衍生化,检测时间延长,且因衍生化产物相同而无法区分RNZ和HMMNI,故NIIMs的检测越来越趋向于LC-MS(表5-32)。
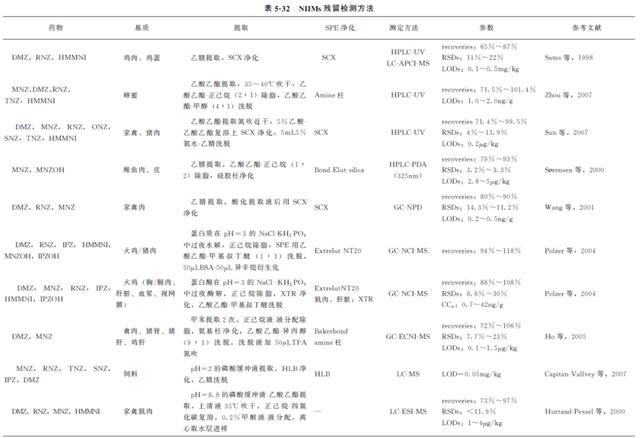
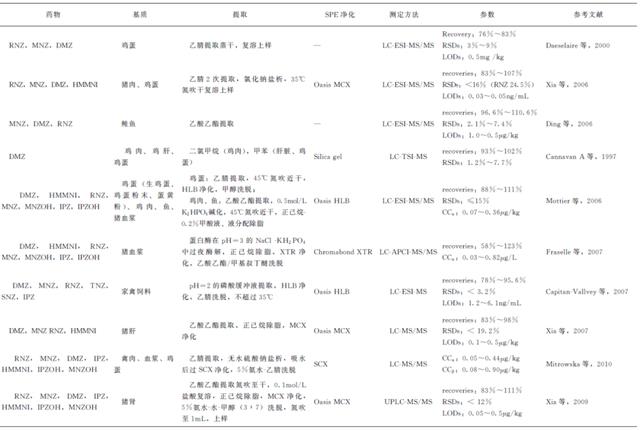
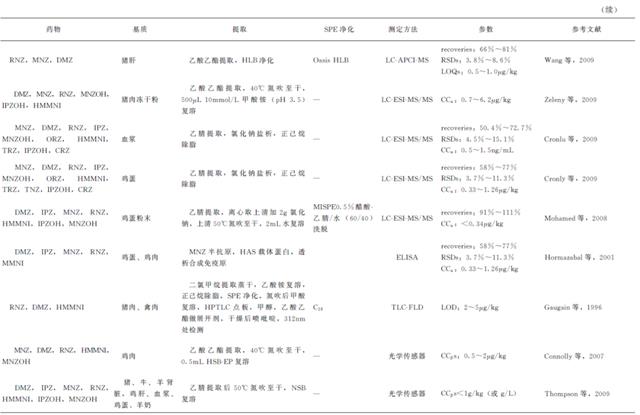
6.1 GC
由于NIIMs是含氮易挥发药物,因此氮磷检测特异性高。Wang建立了一种测定鸡肉中DMZ、MNZ和RNZ多残留的GC-NPD法,不需衍生化,内标法定量。称取5g鸡肉用25mL乙腈提取2次,加入5g无水硫酸钠,离心取上清液,再用无水硫酸钠吸收提取液中水分,加5mL乙酸酸化提取液后用SCXSPE柱净化。用乙腈-乙酸(95∶5)活化柱子后上样,依次用25mL丙酮、5mL甲醇、5mL乙腈淋洗,用5mL乙腈-28%氨水(95∶5)洗脱。向洗脱液中加100μL乙二醇-甲醇(10∶90)后氮吹至干,用1mL含80μg/L的TPP甲醇复溶上样。以空白样品提取液3倍信噪比计算,DMZ和MNZ的检测限为0.2ng/g,RNZ为0.5ng/g。DMZ、RNZ和MNZ添加浓度为5μg/kg时,3种药物的回收率分别为85%、90%和80%,变异系数分别为13.0%、14.3%和11.2%。离子化的药物通过离子相互作用保留在SCX柱上。加入乙二醇防爆沸,避免氮吹温度超过40℃,从而提高回收率。NIIMs易于吸附在玻璃器皿上,因此前处理全部用塑料管。
6.2 GC-MS
GC-MS集高灵敏度和定性分析于一体,在NIIMs的检测中应用较为广泛。Polzer和Gowik建立了测定火鸡肉、猪肉中DMZ、RNZ、MNZ、IPZ、HMMNI、MNZOH和IPZOH的GC-NCI-MS方法。称取5g样品,加入6mL氯化钠-磷酸二氢钾缓冲液、1mL蛋白酶,在pH=3的条件下,37℃过夜酶解。离心后弃上清液,加入8mL缓冲液,离心取水相,加缓冲液至20mL,正己烷除脂(2次),Extrelut柱净化,用20mL乙酸乙酯-甲基叔丁醚(1∶1,V/V)洗脱2次,氮吹洗脱液至0.5mL后,加入50μL BSA-50μL异辛烷50℃衍生化60min,生成TMS衍生化产物后进行GC-MS测定。DMZ、HMMNI、RNZ、MNZ和MNZOH的检测限为0.65~2.8μg/kg,IPZ和IPZOH的检测限为5.2μg/kg,回收率为94%~118%。但是RNZ和HMMNI衍生化产物相同,因为RNZ的碳酸甲酯基团被破坏,形成与HMMNI相同的三甲基硅醚,因此用GC-MS无法区分RNZ和DMZ与RNZ的共同代谢物HMMNI。
Ho建立了一种测定禽肉、猪肾、猪肝、鸡肝中DMZ、MNZ残留的GC-NCI-MS,内标法定量。称取2g样品,加无水硫酸钠,用5mL甲苯2次提取,离心取上清液,与10mL正己烷混合,NH2柱净化。首先在SPE柱上加1g无水硫酸钠,用正己烷淋洗后上样,真空干燥后,用5mL乙酸乙酯-异丙醇(9∶1,V/V)洗脱,向洗脱液中加50μLTFA氮吹近干,加入0.1mLBSA70℃衍生化30~45min,过滤膜后上机测定。检测限为0.1~0.6μg/kg,定量限为0.3~1.9μg/kg。当DMZ添加浓度在1~9μg/kg时,回收率为101%~106%,变异系数为7.7%~11%;当MNZ添加浓度为0.2~2μg/kg时,回收率为72%~90%,变异系数为14%~23%。
SPE净化时,即使样品中有痕量的水都会对方法的回收率和精密度产生很大影响,因为水分子会和SPE上的氨基位点相互作用,影响净化效果,因此提取和净化过程中必须加足够的无水硫酸钠。DMZ在浓缩时损失较大,为了提高DMZ的回收率,减少氮吹损失,还比较了在洗脱液中加DMF、TFA或乙酸,40℃与25℃氮吹比较,发现加DMF可提高DMZ的回收率,且TFA或25℃氮吹可使DMZ的回收率提高1倍。DMZ的衍生化用BSA可避免产生荧光产物,且可减少NCI-MS检测的背景噪声。
6.3 LC
在分析NIIMs时,用水相和低极性有机溶剂如乙腈、甲醇组成的二元流动相系统,采用梯度洗脱是常用的方法,甲酸、乙酸或磷酸等酸性缓冲液可用来保持洗脱过程中适当的pH。含有缓冲液的乙腈是最常用的流动相,但长时间用酸性流动相有可能缩短色谱柱使用寿命,且高浓度的磷酸钾可以腐蚀泵的密封塞。因此可采用水-乙腈-甲醇三相流动相梯度洗脱以避免使用酸缓冲液。Sun等发现低比例乙腈的梯度易于分离较强极性的HMMNI、RNZ、MNZ,高比例乙腈的梯度可以更快地洗脱极性最弱的ONZ。另外,甲醇可以增加峰高、缩短分析时间。
由于NIIM曾被批准可作为动物促生长剂,所以20世纪80年代有大量关于饲料中NIIMs残留的研究,但这些方法中可测定的药物种类不超过3种,常用LC-UV检测,LOD通常大于1mg/kg。
农业部发布的检测动物源性食品中MNZ、DMZ、RNZ多残留的HPLC法适用于鸡的肌肉、肝脏组织中单种或多种药物残留的检测,检测限为1μg/kg,在6~50μg/kg添加浓度时回收率为60%~120%。样品先用乙酸乙酯提取,并经液-液萃取、SPE净化等过程,处理方法较为复杂。
王建华等建立了鸡肉组织中MNZ、DMZ和RNZ残留检测的HPLC法和LC。HPLC法中采用二氯甲烷提取后,提取液直接过硅胶SPE柱净化,样品添加浓度为10~50μg/kg时,平均回收率为78%~91%,但灵敏度较低,检测限为10μg/kg。艾霞等建立了鸡蛋、牛奶及鱼肌肉和鱼皮中MNZ残留检测的HPLC法。鸡蛋和牛奶样品用乙酸乙酯提取,鱼肌肉和鱼皮用乙腈提取,提取液旋转蒸干,残余物用正己烷-乙酸乙酯(2∶1,V/V)溶解,过SPE柱,洗脱液用氮气吹干后复溶于流动相进样分析。MNZ在各组织中的检测限均可达1.0μg/kg,空白鸡蛋、牛奶和草鱼中添加MNZ浓度为1μg/kg、2μg/kg和4μg/kg时,回收率为65%~82%,变异系数为6%~12%。
Sams用LC-UV在315nm处测定鸡蛋、鸡肉中DMZ、RNZ及其代谢物残留,再用HPLC-APCI-MS进行确证。Sun用LC-UV在320nm处测定家禽和猪肉中7种NIIMs,在315nm处测定蜂蜜中MNZ、DMZ、RNZ、TNZ和HMMNI。Srensen和Hansen报道了LC-DAD方法测定虹鳟肌肉和鱼皮中MNZ及其代谢物MNZOH。Zhou测定了蜂蜜中MNZ、DMZ、RNZ、TNZ和HMMNI残留,用乙酸乙酯提取,氨基柱净化,LC-UV在315nm处检测,方法的LOD为0.1~2ng/g,回收率为71.5%~101.4%。
6.4 LC-MS
尽管基于ELISA或生物传感器的传统的生物测定方法可快速筛选阴性和阳性样品,但目前常用质谱(MS)作为确证手段检测可疑样品。欧盟2002/657/CE指令中规定“仅用色谱分析而不用质谱测定的方法不能作为确证方法”。目前MS和GC、LC联用是饲料和食品中兽药残留检测和定量确证的最佳方法。在NIIMs的残留检测中,由于GC-MS的局限性,LC-MS联用技术得到了广泛应用,大气压化学电离(APCI)和电喷雾电离(ESI)方法均有报道。
Hurtaud-Pessel等建立了测定猪肉和鸡肉中4种NIIMs的LC-ESI-MS方法,称取4g样品,加入1.6mL0.5mol/L的磷酸缓冲液(pH8.8)和8mL乙酸乙酯提取,离心取6.0mL上清液在35℃水浴中旋蒸浓缩至干,残余物用400μL正己烷-四氯化碳(1∶1,V/V)和400μL0.2%甲酸复溶,17300g离心2min,取上层水相进样检测。内标法定量,SIM模式监测[M+H]+和[M+H+CH3CN]+,0.2%甲酸-甲醇-乙腈三相流动相,LOD为5μg/kg。NIIMs光敏感性较强,因此前处理尽量在避光条件下完成。该方法省去SPE净化步骤,并发现旋蒸过干和过热都会影响回收率,因此选择沸点较低的乙酸乙酯为提取液,然后35℃水浴浓缩。另外,该方法也可用于测定肉中DMZ、MNZ和RNZ残留。
Xia等建立了应用LC-ESI-MS/MS测定猪肝中4种NIIMs的方法,LOD为0.1~0.5μgk/g取5g肝脏组织,加入15mL乙酸乙酯(提取2次),离心取上清液,40℃氮吹至干。加入5mL正己烷和3mL0.1mol/L盐酸涡动复溶,液-液萃取除脂,离心弃正己烷,下层溶液上OasisMCXSPE柱净化。SPE柱先用2mL甲醇和2mL水活化,上样后依次用2mL0.1mol/L盐酸、1mL甲醇、1mL含2%氨水的甲醇-水(10∶90)溶液淋洗,最后用2mL含2%氨水的甲醇-水(30∶70)溶液洗脱,洗脱液于40℃氮吹至接近1mL后加水定容至2mL进样。研究发现该方法有明显的离子抑制效应,通过优化SPE淋洗条件和洗脱液以分离目标分析物,分别用含2%氨水的10%甲醇淋洗和30%甲醇洗脱,可降低离子抑制效应。
Reinhard报道了检测冻干猪肉中NIIMs残留的方法,1.5g冻干猪肉粉末加水至5g,加入15mL乙酸乙酯提取,2200g4℃离心15min,取上清液10mL,40℃氮气吹干,加入500μL10mmol/L甲酸铵(pH3.5),2200g4℃离心10min,过0.2μm滤膜后进样分析,LC-MS/MS检测。LOD为0.36~0.54μg/kg,回收率为92%~107%。
Mottier等建立了测定鲜鸡蛋、全鸡蛋粉、蛋黄粉、鸡肉和鱼肉中4种NIIMs及其3种代谢物的LC-ESI-MS/MS方法,内标法定量。鸡蛋及其制品用乙腈超声提取,提取液转至含2g氯化钠的离心管中,以除去乙腈提取液中水溶性杂质,离心后将上清液在45℃氮吹至近干,用水复溶后,OasisHLB净化,5%甲醇淋洗后用2mL甲醇洗脱,氮吹至5~10μL后用500μL水复溶,过0.45μm尼龙滤膜后进样。鸡肉和鱼肉组织用0.5mol/L磷酸二氢钾碱化的乙酸乙酯提取2次,氮吹近干,500μL正己烷复溶,再加入500μL0.2%甲酸液-液萃取,取水相过滤膜后进样分析。LOD为0.11~0.6μg/kg,回收率为88%~111%。该方法同时研究了NIIMs主要碎片离子的断裂途径。DMZ的m/z96的碎片是由质子化的分子离子(m/z142)断裂硝基(NO2)获得;m/z81(C4H5N2)碎片是由咪唑环打开后失去CH3NO2所得。IPZ离子断裂途径和DMZ相似,分别为m/z124和m/z109。MNZ(m/z172)失去H2C=CHOH基团后得到m/z128,该碎片随后失去NO2基团得到m/z82。RNZ(m/z201)的碎片离子m/z140是失去HO-CO-NH2后获得的,m/z55是咪唑环开环后失去C4H6O4N2获得的。HMMNI(m/z158)失去水分子后得到m/z140,咪唑环打开后失去NO2-C=CH和甲醇分子后得到m/z55。IPZOH(m/z186)的碎片离子m/z168和m/z122是由先后丢失水分子和硝基后获得的。MNZOH(m/z188)相继失去水分子和H2C=CHOH后得到m/z126,该碎片离子失去硝基和水分子再环化后得到m/z123。
Cronly等建立了一种快速、灵敏、特异性强的检测血浆中10种NIIMs残留的LC-MS/MS确证和定量方法,内标法定量。5mL血浆,加入10mL乙腈提取,2g氯化钠盐析除去水中杂质,60℃氮吹至6mL。加5mL正己烷除脂,弃正己烷后下层溶液氮吹至干,200μL水-乙腈(95∶5)复溶,过膜进样。方法的LOD为0.8~26ng/mL。试验中比较了1次提取和2次提取回收率的区别,结果发现2次提取回收率提高并不明显,因此仅用1次提取即可。过膜步骤中,比较了聚偏氟乙烯(PVDF)、聚四氟乙烯(PTFE)和尼龙滤膜,发现PTFE、尼龙滤膜会降低药物回收率,因此采用0.25μm的PVDF膜。Cronly等还采用此方法检测了鸡蛋中11种NIIMs及其代谢物残留。
Fraselle等建立了测定猪血浆中4种NIIMs及其3种代谢物残留的LC-APCI-MS/MS方法,内标法定量,前处理方法中包括蛋白酶过夜水解,用XTR柱固相萃取净化。但是该方法在IPZ和IPZOH处有干扰,对此两种药物只能定性而不能定量测定。
Polzer等用LC-MS/MS方法开展了火鸡体内NIIMs的均质性研究、稳定性试验及降解代谢研究。发现分别饲喂含DMZ、IPZ的饲料后,体内含量多的是其代谢物HMMNI、IPZOH;而饲喂RNZ、MNZ的动物,体内含量较高的是原药。药物在肌肉中的分布并不均匀,只有在血浆和视网膜中才分布均匀且残留浓度高;比较了4℃和室温放置,发现肉中药物在室温下降解迅速,而在血浆和视网膜中稳定,休药一段时间后仍可检出。因此可将血浆和视网膜作为检测火鸡体内NIIMs残留的靶组织。
6.5 免疫学方法
有关检测NIIMs残留的快速筛选方法报道不多,主要有ELISA和生物传感器方法,均不需要昂贵的仪器设备。
Huet等建立了鸡肉和鸡蛋中DMZ、MNZ、RNZ、HMMNI和IPZ残留的ELISA检测方法,制备了针对MNZ的抗体,与DMZ、RNZ、HMMNI、IPZ有交叉反应,样品用乙腈萃取、正己烷去脂,回收率为18%~98%,检测限为DMZ<1μg/kg(鸡蛋)、DMZ<2μg/kg(鸡肉),MNZ<10μg/kg,RNZ<20μg/kg,HMMNI<20μg/kg,IPZ<40μg/kg。
Thompson等建立了用免疫生物传感器检测不同样品和不同生物基质中NIIMs多残留的方法,包括猪、牛、羊的肾脏,禽类的肝脏、血浆和鸡蛋及牛奶。可结合至少7种NIIMs及其代谢物的多克隆抗体由MNZ蛋白结合物免疫羊而获得。样品用乙腈提取,该方法DMZ的检出限在不同种类动物的不同基质中均低于1μg/kg(或μg/L),试验还表明该方法对其他主要的NIIMs及其代谢物包括RNZ、IPZ、MNZ、MNZOH、HMMNI和IPZOH均有交叉反应。
相关参考
旋蒸的转接头叫什么(动物源性食品中兽药残留的检测——磺胺类药物残留)
...胺结构的一类药物的总称,是一类广泛使用的预防和促进动物生长(常做饲料添加剂)的抗生素。SAs均含有p-氨基苯甲酰环、N4位芳香族氨基酸,而N1位取代基则不同。SAs种类可达数千种,具有抗菌谱较广、性质稳定、价格低廉等...
氯化亚锡溶液是澄清的吗(动物源性食品中农药残留的检测——氨基甲酸酯类农药残留)
...最早是在20世纪50年代出现的,由于高效、广谱、对高等动物毒性低、原料易得、合成简单,近几十年来得到很快发展,自2007年5种高毒有机磷农药的禁用后,氨基甲酸酯类农药成了较主要的替代品种,是国内外一类主要的农药杀...
氟硼酸烘干机品牌(动物源性食品中霉菌毒素的检测——伏马菌素)
伏马菌素(fumonisin,FB)是一类由串珠镰刀菌、轮状镰刀菌、再育镰刀菌等产生的真菌毒素,主要存在于玉米等谷物中,在以谷物为原料的产品中也有发现。迄今为止,研究者已发现28种伏马,其中主要且毒性较大的是伏马菌素B...
...肠道中最早被发现,以后又在猪、羊、犬、鸡及多种野生动物的腹泻粪便和正常粪便中检出,在我国的分布也十分广泛。该菌属有胎儿弯曲杆菌(Campylobacterfetus)、空肠弯曲杆菌(Campylobacterjejuni)、唾液弯曲杆菌(Campylobactersput...
...肠道中最早被发现,以后又在猪、羊、犬、鸡及多种野生动物的腹泻粪便和正常粪便中检出,在我国的分布也十分广泛。该菌属有胎儿弯曲杆菌(Campylobacterfetus)、空肠弯曲杆菌(Campylobacterjejuni)、唾液弯曲杆菌(Campylobactersput...
微孔板恒温孵育器(动物源性食品中细菌的检测——金黄色葡萄球菌)
金黄色葡萄球菌(Staphyloccocusaureus,S.aureus)是一种重要病原菌,隶属于微球菌科Micrococcaceae)、葡萄球菌属(Staphyloccocus),在《伯杰氏系统细菌学手册》(Bergey’smanualofsystematicbacteriology)(2004))中金黄色葡萄球菌被分为19个...
水相和有机相微孔滤膜(动物源性食品中有害化学物质及污染物的检测———孔雀石绿)
...廉、效果显著等优点,被广泛应用于预防与治疗各类水产动物的水霉病和对原虫的控制。非洲一些国家还用其控制细菌、绦虫、线虫和吸虫等的感染。20世纪90年代开始陆续有研究表明,孔雀石绿进入人类或动物机体
食品安全快速检测仪可检测农药残留、兽药残留、重金属、滥用食品添加剂、非食用化学物质等项目,该仪器是一款集成化食品快检仪器,仪器检测项目多,检测功能齐全。通过食品安全快速检测仪的检测,可直观了解到被测样...
食品安全快速检测仪可检测农药残留、兽药残留、重金属、滥用食品添加剂、非食用化学物质等项目,该仪器是一款集成化食品快检仪器,仪器检测项目多,检测功能齐全。通过食品安全快速检测仪的检测,可直观了解到被测样...
...,如甲苯、二甲苯、乙酸乙酯、丁酮、乙酸丁酯、乙醇、异丙醇等。这些溶剂或多或少地残留在包装材料中,若含有较高溶剂残留的包装材料用来包装食品,将会危害人们的身体健康;因此必须对溶剂残留量进行检测。总迁移量...