昆虫细胞杆状病毒表达系统(瑞科生物研究报告:自主研发为核心驱动力的疫苗Biotech)
Posted
篇首语:幽映每白日,清辉照衣裳。本文由小常识网(cha138.com)小编为大家整理,主要介绍了昆虫细胞杆状病毒表达系统(瑞科生物研究报告:自主研发为核心驱动力的疫苗Biotech)相关的知识,希望对你有一定的参考价值。
昆虫细胞杆状病毒表达系统(瑞科生物研究报告:自主研发为核心驱动力的疫苗Biotech)
(报告出品方/作者:中信证券,朱奕彰)
公司概况:自主研发为核心驱动力的创新型疫苗企业
九价HPV疫苗国内研发进度领先,生产基地建设快速推进
自主研发新型佐剂,九价 HPV 疫苗国内研发进度领先。江苏瑞科生物技术股份有限 公司(以下简称“公司”,股票代码:2179.HK)成立于 2012 年,以自主研发技术为核心 驱动力,是国内少数几家能够研发对标 FDA 批准的新型佐剂(AS01、AS03、AS04、 CpG1018 和 MF59)的疫苗公司之一。截至 2022 年底公司拥有 12 种高度差异化组成的 高价值创新型疫苗组合,覆盖宫颈癌、带状疱疹、新冠肺炎、流感等具有重大负担的疾病 领域。核心产品重组九价 HPV 疫苗 REC603,正处于 III 期临床试验阶段,国内研发进度 领先。
深受创投机构追捧,多轮融资快速推进公司业务进展。公司上市前得到多家创投机构 支持,总融资金额超过 23 亿人民币,其中不乏君联资本、红杉资本、淡马锡等著名创投 机构。融资资金推动公司临床试验快速进行,根据公司公告,公司九价 HPV 疫苗项目临 床 III 期的主效力试验首次入组时间为 2021 年 6 月,2021 年 10 月就已经完成全部 13,400 人的入组,2022 年 5 月完成全程三针的接种;小年龄组免疫桥接试验与 Gardasil 9 免疫 原性比较试验完成入组和首剂接种工作。新冠肺炎疫苗也已在菲律宾开展基础免疫的临床 II/III 期试验,在阿联酋开展序贯免疫的临床 II/III 期试验。
公司 HPV 产业化基地 I 期工程已完成封顶,经过工艺优化、产业化升级,最高可满 足年产 2000 万剂重组九价 HPV 疫苗。公司重组新冠肺炎疫苗产业化基地也已完成建设, 已形成产能 1 亿剂,并具备快速扩充到 3 亿剂的能力,且该生产基地也可用于生产重组带 状疱疹疫苗。

豪华高管团队阵容,持股平台激发员工积极性
公司管理团队具有丰富的疫苗产品开发研究和商业化经验。公司创始人刘勇博士曾担 任中国疾控中心研究教授,主导了 HIV DNA 疫苗的开发,拥有 20 多项发明专利。副总经 理周红军博士曾主导包括 Hib 疫苗、十三价及二十三价肺炎疫苗的商业化上市。其他高管 也都拥有相关丰富的工作经验,助力公司创新型疫苗研发、生产和商业化工作。
公司发展过程中引入多家创投机构作为公司的早期投资人,公司股权比较分散,刘勇 作为公司实际控制人拥有对公司的绝对控制权。公司积极设立员工持股平台,以促进员工 积极性和业务快速发展,以泰州元工、连云港瑞百泰、泰州古泉、泰州百倍以及连云港瑞 百和等组成的员工持股平台持有公司 20%以上的股份,作为进行员工股权激励的主要载体。
对核心员工进行股权激励以促进公司业务快速推进。公司在 2021 年多次定向对公司 核心员工进行授予股权的激励措施,总授予股权价值超过 3,000 万人民币,授予对象包括 公司高管和各业务线重要负责人员。公司积极建设员工持股平台以及进行股权激励有利于 提高公司员工整体积极性,促进公司业务快速发展。
高价值创新型研发管线,高研发投入形成战略性亏损
公司深耕疫苗领域多年,基于自主构建的新型佐剂、蛋白工程和免疫评价三大创新技 术平台,公司建立共计 12 款覆盖宫颈癌、新冠肺炎、带状疱疹、结核病、流感、手足口 病等具有重大负担疾病的创新型疫苗管线。其中潜在核心品种九价 HPV 疫苗项目临床 III 期主效力试验正在进行随访;小年龄组免疫桥接试验与 Gardasil 9 免疫原性比较试验完成 入组和首剂接种工作。根据公司公告,新冠肺炎疫苗 ReCOV 开展全球多中心基础免疫的 临床 III 期试验,在阿联酋开展序贯免疫的临床 II/III 期试验,与辉瑞 mRNA 疫苗的对比研 究取得优效。
聚焦重组疫苗技术路线,自主研发新型佐剂
重组蛋白疫苗应用广泛,具有成本效率优势
疫苗按不同技术路线可分为灭活疫苗、减毒活疫苗、重组蛋白疫苗、核酸疫苗(mRNA 疫苗和 DNA 疫苗)以及重组载体疫苗(病毒载体和细菌载体),其中灭活疫苗和减毒活疫 苗都保留病原体完整结构,被称为病原体疫苗,重组蛋白疫苗、核酸疫苗和重组载体疫苗 都运用到基因工程学的工具,又被称为亚单位疫苗或基因工程疫苗。重组蛋白疫苗具有研 发速度快、安全性高、容易放大生产等优点,广泛应用在新冠肺炎疫苗、乙肝疫苗、HPV 疫苗、带状疱疹疫苗等疫苗品类。
重组蛋白疫苗制备过程是使用基因工程工具将病毒目标基因序列植入工具细胞(如大 肠杆菌、酵母细胞、CHO 细胞等)的基因组中,在一定的培养条件下表达所需的抗原蛋 白,经过纯化和佐剂进行混合制备成疫苗。制备过程不涉及活病毒,无需经过灭活疫苗步 骤,相较于减毒活疫苗更安全,避免改变病毒蛋白免疫原性的可能,更容易大规模生产, 具有低成本高效率的优势。根据 Frost & Sullivan 估计(转引自公司招股书),2020 年中 国基因工程疫苗占比 55.4%,到 2030 年占比将达 86.6%。
基因工程疫苗是疫苗领域未来发展趋势,当前重组蛋白疫苗应用最为广泛。2021 年 全球十大畅销疫苗(不包括新冠肺炎疫苗)有八种为重组蛋白亚单位疫苗。随着免疫学、 分子生物学、生物技术的发展,基因工程疫苗进入快速发展阶段,新冠肺炎在一定程度也 促进了核酸疫苗和病毒载体疫苗的产业化进展,未来基于基因工程学的创新型疫苗将是疫 苗产业的中流砥柱。在所有基因工程疫苗中,重组蛋白技术路线最有效、最安全且相对实 惠,因此当前应用最为广泛。
佐剂是重组蛋白疫苗重要组成部分,公司具备自主研发能力
相较于灭活疫苗和减毒活疫苗包含多种抗原和其他病原体成分的传统疫苗,重组蛋白 疫 苗 由 于 组 成 成 分 为 高 纯 度 的 抗 原 蛋 白 , 常 常 缺 乏 病 原 相 关 分 子 模 式 (pathogen-associated molecular patterns,PAMPs),较难激活先天免疫,需要添加佐 剂辅助触发先天性免疫反应,进而启动下游适应性免疫。佐剂的功能类似于 PAMPs,通 过多种机制触发先天性免疫反应,识别出疫苗成分构成“威胁”,进而激活适应性免疫反 应,增强抗原呈递细胞对抗原摄取和呈递能力。因此佐剂具有增强免疫原性、改变免疫应 答性质,延长抗原作用时间等功能。
铝佐剂应用最多,创新型佐剂存在“卡脖子”问题。目前铝佐剂仍然是人用疫苗中唯 一广泛使用的佐剂,但铝佐剂也存在极大的缺点,铝佐剂对增加血清抗体通常有效,但会 引起注射部位反应,诱导细胞免疫的能力较弱。重组蛋白疫苗发展极大推动了 AS04、AS01、 CpG1018 等新型佐剂的发展。疫苗佐剂一般不会作为一种药物单独获批,而是作为疫苗 的组成成分获批,目前 FDA 批准的应用于人体疫苗的新型佐剂只有五种。由于新型疫苗 佐剂通常生产难度较高,或者某些天然成分来源有限,新型佐剂系统一直被国外企业所控 制。例如新型佐剂重要组成成分角鲨烯天然来源有限、人工合成繁琐产量低。单磷酸酰脂 质 A(MPL)的工艺要求高,分离和提纯十分困难。
HPV疫苗:公司核心布局产品,基于新型佐剂有望实现弯道超车
HPV与宫颈癌密切相关,疫苗接种是最有效预防手段
人乳头瘤病毒(human papilloma virus,HPV)是一种双链环状 DNA 病毒,能引起 人体皮肤黏膜的鳞状上皮增生,与子宫颈癌等癌变密切相关。目前已经发现了 100 多种 HPV 基因型,其中有 30-40 多种与人类生殖道感染相关。在有性生活史的女性中生殖道 HPV 感染具有普遍性,根据 IRAC 数据,全球范围内不同地区宫颈细胞学正常妇女 HPV 感染率在 4%-30%之间(平均 11.7%),中国宫颈细胞学正常女性人群中 HPV 感染率为 9.7%-21.8%。
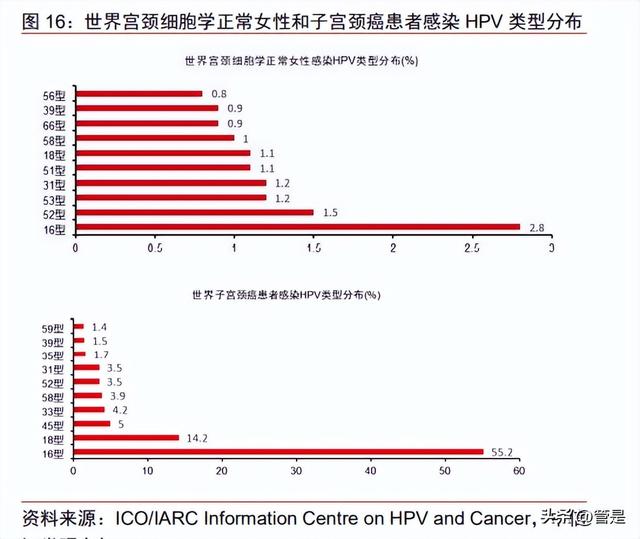
中国 HPV 流行病学与世界水平有所类似。中国宫颈细胞学正常女性感染 HPV 类型前 十为 HPV 52/16/58/33/18/31/39/51/56/45 型,世界范围内宫颈细胞学正常女性感染 HPV 类型前十为 HPV 16/52/53/31/51/18/58/66/39/56 型。中国子宫颈癌患者感染 HPV 类型前 十为 HPV 16/18/58/52/33/31/59/45/39/56 型,世界范围内子宫颈癌患者感染 HPV 类型前 十为 HPV 16/18/45/33/58/52/31/35/39/59 型。16/18 型在子宫颈癌患者人群中频率最高, 合计占比将近 70%。
HPV 可根据危险性分为高危型、中危型和低危型。高危型和中危型与宫颈癌、口咽 癌、头颈癌、阴道癌、外阴癌、阴茎癌和肛门癌等组织癌变有关,而低危型主要引起组织 的良性病变,如尖锐湿疣、肛门和外生殖器疣、扁平疣和跖疣等皮肤病变。根据 WHO 国 际癌症研究机构(IARC),高危型主要包括 HPV16、18、31、33、35 等 12 种基因型。
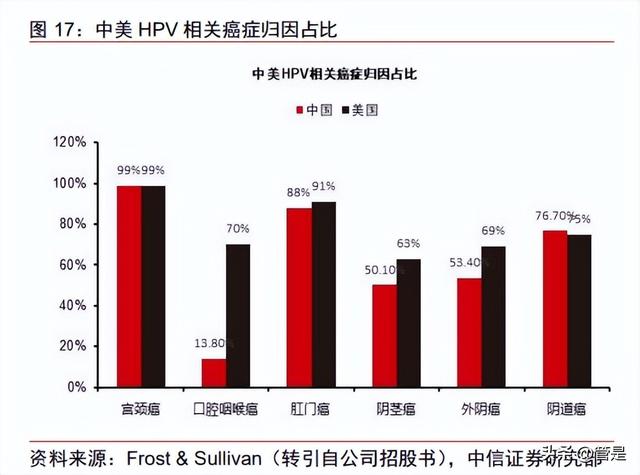
HPV 可能会导致人体不同位置的病变,宫颈癌病变高度归因于 HPV 感染。高危型 HPV 可引起宫颈癌、口咽癌、头颈癌、阴道癌、外阴癌、阴茎癌和肛门癌等病变。根据 Frost & Sullivan(转引自公司招股书),在中国,99%的宫颈癌患者,88%的肛门癌患者 和 76.7%的阴道癌患者可归因于 HPV 感染;在美国,99%的宫颈癌患者,91%的肛门癌 患者和 75%的阴道癌患者的致病因素为 HPV 感染。中国因 HPV 感染引发宫颈癌人数远 超过美国。美国将 HPV 疫苗纳入免疫规划,而中国尚未将 HPV 疫苗纳入免疫规划,中国 五年平均因 HPV 感染引发宫颈癌人数达到 11.45 万人,远远超过美国的 1.30 万人。
HPV 疫苗接种是消除宫颈癌的重要手段。对于宫颈癌综合控制包括一级预防(接种 人乳头状瘤病毒疫苗)、二级预防(筛查和治疗癌前病变)、三级预防(诊断和治疗浸润性 宫颈癌)和姑息治疗。在宫颈癌三级预防体系中,HPV 疫苗是最具经济效益的手段,且子 宫颈癌发病与 HPV 感染关系明确,因此有望成为人类通过接种疫苗和筛查消除的第一个 癌症。WHO 提出《加速消除作为公共卫生问题的宫颈癌全球战略》,定下 2030 年实现“90% 的女孩在 15 岁之前全程接种了人乳头状瘤病毒疫苗”、“70%的女性在 35 岁和 45 岁时接 受了高性能筛检”和“90%确诊宫颈疾病的妇女接受治疗”的“90-70-90”目标。这一计 划将快速推进全球范围内的 HPV 疫苗接种。
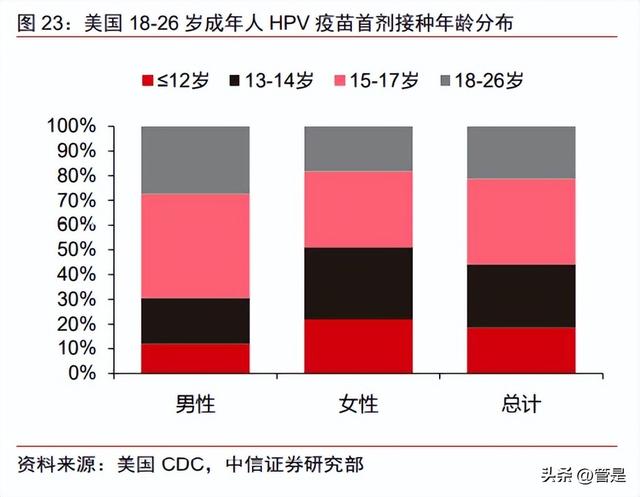
将 HPV 疫苗纳入国家免疫规划能有效提高覆盖率。当前已有 110 个国家将 HPV 疫 苗纳入免疫规划,而仍有 70%的女性(包含人口大国中国和印度)未享受到 HPV 疫苗的 国家免疫规划。纳入免疫规划的国家 HPV 疫苗全程接种率平均为 53%,其中有 22 个国 家 HPV 疫苗全程接种率在 75%以上。截至 2019 年,全球约有 15%的女孩和 4%的男孩 接种了全程疫苗。根据美国 NCHS 调查数据,在美国 18-26 岁成年中,曾经接种 1 剂或 多剂 HPV 疫苗的比例从 2013 年的 22.1%上升到 2018 年的 39.9%,其中女性接种率达到 53.6%,首剂接种年龄大多在 13-17 岁(60%)。
中国 HPV 疫苗纳入免疫规划试点不断扩大。我国 HPV 疫苗尚未纳入国家免疫规划, 但在部分省市,如鄂尔多斯、厦门、济南、广东省、成都、无锡、连云港等都出台了适龄 女性 HPV 接种的优惠政策,且纳入免费接种的基本都为价格更低的国产二价疫苗,我们 预计后续将有更多城市出台 HPV 疫苗接种的相关政策。
HPV疫苗市场空间巨大,市场竞争并不充分
市场竞争不充分,国产品种以性价比优势飞速增长。目前中国市场上市 HPV 疫苗共 有五种,其中三款为进口疫苗,分别是 GSK 的二价 HPV 疫苗、MSD 的四价 HPV 和九价 HPV 疫苗,两款为国产疫苗(馨可宁和沃泽惠),均为二价疫苗,分别于 2019 年 12 月和 2022 年 3 月获 NMPA 批准上市。国产 HPV 疫苗较进口疫苗上市时间晚,但价格更低, 凭借高性价比优势批签发量快速增长。如馨可宁 2020 年批签发量为 245.61 万剂,2021 年批签发量达 1,022.78 万剂,同比增长 316.42%,国产疫苗价格更低,对财政负担更小, 从性价比角度,更容易成为政府免疫规划采购品种。
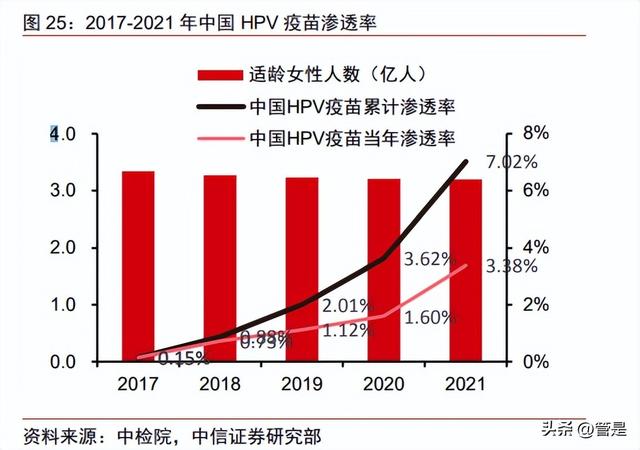
近年来我国 HPV 疫苗总批签发量呈现明显上升态势。2017-2021 年,我国 HPV 疫苗 每年批签发量从 146 万支增至 3249 万支,年复合增长率为 160.65%。按照三针接种程序 粗略测算,2017-2021 年我国 HPV 疫苗的累计渗透率从 0.15%提升至 7.01%。
国产疫苗为免疫规划首选采购品种,市场份额不断扩大。目前中国部分省市 HPV 免 疫规划疫苗所选品种基本都为国产品种,相较于进口产品有着巨大的价格优势。2021 年 万泰二价 HPV 疫苗批签发批次已达到 163 批次,以批签发量计算,万泰生物占据国内 32% 的市场份额。未来随着免疫规划试点的增加,国产疫苗有望占据更多市场份额。
我国每年 HPV 疫苗总接种人数将持续增长。基于 Frost & Sullivan 预测的我国 2022-2031 年女性适龄人数(9-45 岁,万人)和我国 2022-2031 年男性适龄人数(9-45 岁,万人),我们做出以下假设进行我国每年 HPV 疫苗总接种人数和市场规模的预测: 假设 1:由于 HPV 疫苗并非需要年年都打,首先计算出当年未接种 HPV 疫苗人数= 去年未接种 HPV 人群人数-去年接种 HPV 疫苗人数。 假设 2:当年未接种 HPV 疫苗人群的接种率为主观假设。当年接种人数即为当年未 接种 HPV 疫苗人数乘以接种率。 假设 3:HPV 疫苗的男性适应症预计为 2025 年获批(我们根据 MSD 针对男性适应 症的临床试验进度预计)。
假设 4:目前国产二价 HPV 疫苗馨可宁和沃泽惠分别为 329 和 319 元/剂,进口四价 HPV 疫苗 798 元/剂,进口九价 HPV 疫苗 1298 元/剂,2021 年接种人群人均 HPV 费用 为 2350 元。随着更多国产 HPV 疫苗的上市,我们假设接种人群人均 HPV 疫苗费用每年 降幅在 5%,对应中国 HPV 疫苗市场规模 2027 年将达到峰值 702 亿元。
首款国产九价HPV疫苗花落谁家,公司有望以自研佐剂脱颖而出
国产 HPV 疫苗在研同质化严重,九价疫苗竞争最激烈。中国目前进入临床 I 期及之 后的在研公司有 9 家,所研发的品种中二价、四价、九价最多,其中九价研发管线竞争最 为激烈。产品进入临床 III 期的国产企业有瑞科生物(九价),博唯生物(九价、四价), 万泰生物(九价),康乐卫士(九价、三价),成都所/北京所(四价)。此外 MSD 的九价 HPV 疫苗针对 20-45 岁男性的 III 期临床也已经于 2021 年 10 月开启。从入组时间上,最 快的是博唯生物和万泰生物,均在 2020 年 9 月开始 III 期临床的入组。
公司以汉逊酵母作为表达系统,具有高表达水平、易工艺放大等优点。目前已上市 HPV 疫苗的制备技术包括酵母菌表达系统,大肠杆菌表达系统和昆虫细胞-杆状病毒表达 系统。大肠杆菌生长速度更快,表达量更高,有利于实现提高产能、降低成本。酿酒酵母 以葡萄糖、果糖作为碳源和能源,更安全,不易产生毒素。毕赤酵母和汉逊酵母同属于使 用甲醇作为唯一的碳源和能源,与酿酒酵母相比,可实现高密度培养,表达水平更高,利 于分离纯化,更易实现工艺放大。公司基于自研新型佐剂差异化布局,有望实现弯道超车。目前国内 HPV 疫苗基本以 铝盐作为佐剂,技术路线没有明显差异。公司基于自研佐剂进行差异化布局,首先以传统 铝佐剂疫苗作为起点,率先进入市场,然后采用自主研发的新型佐剂对 HPV 疫苗进行革 新换代。
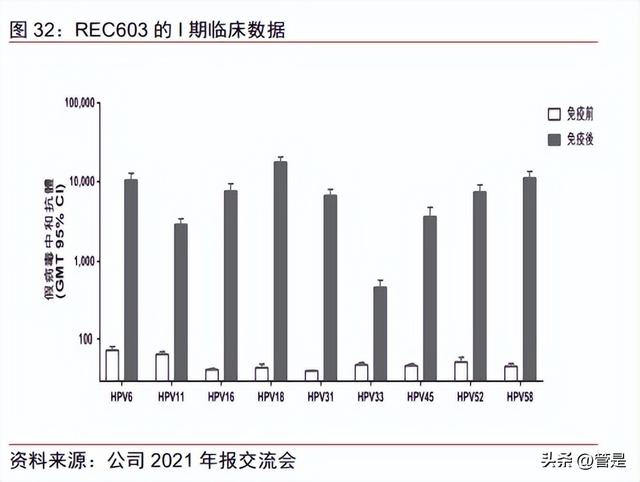
九价 HPV 疫苗率先破局,带来市场新格局。公司九价 HPV 疫苗主效力试验 2022 年 5 月完成三针给药,随访 36 个月取得期中分析条件,公司预计 2025 年提交 BLA 申请。 REC603 的 III 期主效力试验临床设计为随机、双盲对照试验,试验组样本量为 6,700 人, 以 CIN2+宫颈癌病变和持续感染 12 个月的保护效力作为临床终点,小年龄组免疫桥接试 验、与 Gardasil 9 免疫原性比较试验完成入组和首剂接种工作。根据临床前研究数据,公 司九价 HPV 疫苗 REC603 与 Gardasil-9 疫苗具有相似的免疫原性。REC603 的 I 期临床 显示 REC603 安全且耐受良好,疫苗组与安慰组不良事件发生率无统计学差异;且在人体 上的免疫原性良好,针对所有目标 HPV 类型的 NAb GMT 水平有显著增加(定义为 4 倍 增长的中和抗体滴度)。
基于新型佐剂的二代重组疫苗有望改进免疫程序。新型佐剂对于重组疫苗提高免疫原 性具有重要意义,公司基于自主研发的新型佐剂开发出第二代重组 HPV 疫苗,根据临床 前研究,接种两针 REC604a 的免疫原性与 Gardasil 疫苗接种三针的免疫原性相当,有望 改变 HPV 疫苗免疫程序,只需注射两针,仍可获得相同的保护效力。目前国内除了 GSK 基于新佐剂 AS01 的二价 HPV 疫苗上市,尚无其他新型佐剂疫苗上市,公司基于自研新 型佐剂的重组四价 HPV 疫苗 REC604a 对标 GSK 二价(AS01)和 MSD 四价(铝佐剂), 定位在中高端市场,目前国内 IND 申请已获得受理。而基于自研新型佐剂的重组九价 HPV 疫苗 REC604b 对标 MSD 九价(铝佐剂),可面向欧美发达国家以及中国高端用户,形成 阶梯性和有竞争力的市场策略。
新冠疫苗:重组蛋白+mRNA双轮驱动,把握疫苗发展新机遇
新冠呈现泛流感化发展,疫苗具有持续性发展空间
新冠进入 Omicron 时代,新变异体层出不穷。截至 2022 年 12 月 23 日被 WHO 列 入“Variants of Concern”的 Omicron 变异株多达八种,分别是 21K(Omicron)/BA.1、 21L(Omicron)/BA.2、22A (Omicron)/BA.4、22B(Omicron)/BA.5、22C(Omicron)/BA.2.12.1、 22D(Omicron)/BA.2.75、22E(Omicron)/BQ.1、22F(Omicron)/XBB。BA.4/BA.5 于 2022 年 1-2 月在南非首次被发现,之后仅仅几个月的时间迅速取代先前的变异种,目前随着新 变异体的出现,BA.4/BA.5 占比有所下降。
根据 Nextstrain 数据,截至 2022 年 12 月 17 日在新确诊新冠病例中 BA.5 变异株占比为 27%,BA.2 和 BA.2.12.1 变异株占比不断缩小, 新型变异株 BQ.1 和 XBB 在全球新确诊病例中占比在不断攀升,分别升至 45%和 12%的 水平。目前 Omicron 感染者症状绝大多数为无症状或轻症。轻症一般第一天感到轻微咽痛、 身体乏力;第二天出现发热,同时咽部不适感加重;第三天是症状最重的一天,高热 39 摄氏度,浑身酸痛乏力,咽痛加剧;第四天体温从高峰开始下降,但仍然咽痛咽痒,部分 人开始流鼻涕、咳嗽;第五天体温基本降到正常,鼻塞、流涕、咽痛、咳嗽、身体乏力仍 旧存在;第六天不再发热,咳嗽、流涕症状加重;第七天所有症状开始好转,核酸检测很 可能转阴。
新冠防控逐步放开,“每年一打”方案确定性增强。2022 年 12 月 7 日联防联控机制 发布《关于进一步优化落实新冠肺炎疫情防控措施的通知》(联防联控机制综发〔2022〕 113 号),包括《关于印发新冠病毒感染者居家治疗指南的通知》、《关于印发新冠病毒疫 苗第二剂次加强免疫接种实施方案的通知》等标志着我国新冠疫情防控迎来实质性放开, 进入预防重症和病死的阶段。2022 年 12 月 26 日联防联控机制发布《关于印发对新型冠 状病毒感染实施“乙类乙管”总体方案的通知》(联防联控机制综发〔2022〕144 号),自 2023 年 1 月 8 日起将新型冠状病毒感染从“乙类甲管”调整为“乙类乙管”,标志着新冠 防控进入新的阶段。
2022 年 12 月 13 日联防联控机制综合组发布《关于印发新冠病毒疫 苗第二剂次加强免疫接种实施方案的通知》,对于感染高风险人群、60 岁以上老年人群、 具有较严重基础性疾病人群和免疫力低下人群,可在第一剂次加强免疫接种基础上,间隔 六个月开展第二剂次加强免疫接种。当前所有批准附条件上市或紧急使用的疫苗均可用于 第二剂次加强免疫。我们认为新冠呈现流感化发展,新冠疫苗产生的中和抗体水平 6 个月 就降低到较低水平,难以维持保护效果。第二剂加强目前已提上日程,我们认为未来新冠 疫苗需求具有持续性,“每年一打”方案确定性增强。
公司高度差异化的新型佐剂重组蛋白新冠疫苗优势明显
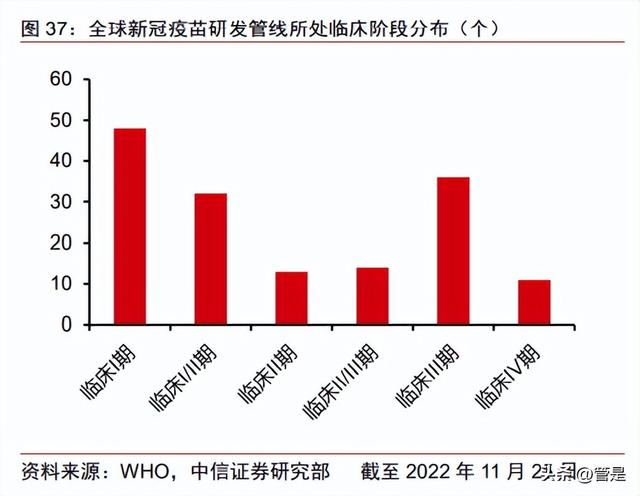
重组蛋白疫苗为新冠疫苗研发首选技术路线。根据 WHO 数据,截至 2022 年 11 月 25 日全球在研新冠疫苗处于临床阶段的共有 156 个,其中重组蛋白技术路线最多为 52 个; 从临床阶段分布来看,处于临床 III/IV 期的有 47 个。全球共有 32 款新冠肺炎疫苗上市(紧 急使用授权或附条件上市),其中 11 款为重组蛋白疫苗。截至 2023 年 1 月 4 日中国共批 准 13 款产品上市,分别是国药中生武汉所、北京所、北京科兴、智飞生物、康希诺、康 泰生物、丽珠集团、万泰生物、神州细胞、三叶草生物、威斯克及中国医学科学院医学生 物学研究所,其中 5 款为灭活疫苗,5 款为重组蛋白疫苗,3 款为腺病毒载体疫苗(包括 1 款康希诺的吸入剂型)。在所有商业化或处于临床阶段的重组蛋白新冠疫苗,公司的 ReCOV 是唯一采用 NTD 及 RBD 组合作为目标抗原的疫苗。
高度差异化的新型佐剂重组蛋白新冠疫苗。ReCOV 使用优化抗原(NTD-RBD-foldon 三聚体),包含 N 末端结构域(NTD)及受体结构域(RBD),由 CHO 细胞高度表达,可 以形成与天然棘突蛋白高度相似的结构。与全长棘突蛋白抗原相比,NTD-RBD-foldon 三 聚体关键抗原表位更多,拥有更强的免疫原性转化潜力,较低的 ADE 风险及更高的蛋白 质产量。与 RBD 亚单位疫苗相比,NTD-RBD-foldon 三聚体抗原包含更保守的表位,对 新出现的变异株具有更好的交叉保护效果。此外 ReCOV 采用公司自研新型佐剂 BFA03, BFA03 是基于角鲨烯的水包油佐剂,可引发细胞因子的短暂产生,激活先天性免疫反应, 增强具有抗原特异性的适应性免疫应答。
目前公司重组新冠肺炎疫苗在菲律宾完成基础免疫的临床 II 期试验,初步研究结果显 示总体安全性良好,未发生疫苗相关严重不良反应,全球多中心 III 期临床完成首批受试 者入组。公司在阿联酋开展序贯免疫的临床II/III期试验,公司预计2023年初提交EUA/BLA 申请。同时,ReCOV 于 2022 年 5 月 2 日获得 NMPA 的临床试验批准。
ReCOV 可诱导高水平的中和抗体,并具有良好的免疫持久性。根据披露的新西兰 I 期临床数据,以及菲律宾 II 期基础免疫临床数据。ReCOV 基础免疫可诱导高水平针对原 型株真病毒的中和抗体,基线血清阴性人群中有更高的血清阳转率及较高的基线增长倍数, 而基线血清阳性人群中有更高水平的中和抗体。此外,ReCOV 具有较好的安全性。根据 I 期临床数据,大部分接种后发生的不良事件(TEAE)为轻度 (1 级),仅 8 例中度 TEAE(3 例为 ADR)。ReCOV 序贯加强免疫可诱导高水平的针对原型株及多种奥密克戎变异株的中和抗体, 其阳转率、较基线增长倍数、几何平均滴度均显著高于灭活疫苗。根据公司官网披露数据, ReCOV 序贯加强免疫诱导的针对奥密克戎各种变异株的中和抗体水平较原型株仅下降 1.5~3.0 倍。
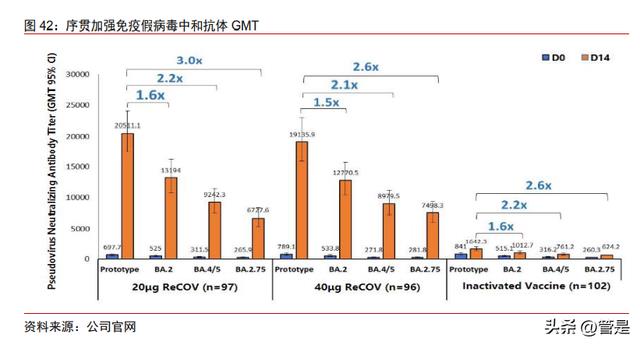
ReCOV 诱导的针对奥密克戎变异株相比原型株的中和抗体下降倍数,明显低于其他 新冠疫苗数据。ReCOV 序贯加强相比灭活疫苗同源加强诱导的中和抗体升高倍数,明显 高于其他新冠疫苗数据。根据 2022 年 12 月 23 日公司公告,ReCOV 序贯加强诱导的针 对奥密克戎变异株 BF.7 和 BA.2.75 的中和抗体水平均显著优于 mRNA 疫苗组(差异有统 计学意义)
合作开发mRNA疫苗,以冻干技术解决超低温运输问题
2021 年公司与瑞吉生物(深圳市瑞吉生物科技有限公司)签署合资协议,成立合资 公司“武汉瑞科吉生物科技有限公司”,就开发 mRNA 疫苗展开合作。瑞吉生物以独特的 mRNA 底层原创技术,积累了多项核心专利。可根据临床及成药性需求,“从底层、从源 头”高效设计开发可及性强的 mRNA 药物。公司候选药物新冠肺炎 mRNA 疫苗 R520A 于 2022 年 6 月获得菲律宾临床试验批准。
冻干 mRNA-脂质纳米颗粒可实现便捷运输与储存。Moderna 的 mRNA 疫苗 (mRNA-1273)需要在-20℃下保存和运输,而 BioNTech 的 mRNA 疫苗(BNT162b2) 更是需要在-70℃下保存和运输。公司开发的冻干脂质纳米颗粒(LNP)mRNA 新冠疫苗, 可以在 4℃或室温下(25℃)储存并具有长期稳定性,提高 mRNA 疫苗的可及性。公司 临床前数据表明冻干剂型对 mRNA 疫苗活性没有影响,冻干 mRNA-脂质纳米颗粒 (lyo-mRNA-WT)与新鲜 mRNA-脂质纳米颗粒(mRNA-WT)免疫原性没有差别,均可 产生明显的中和抗体。
临床前研究表明公司的冻干 mRNA 疫苗可有效保护小鼠免受新冠病毒感染。针对新 冠病毒野生型、Delta 突变株、Omicron 突变株,公司的冻干 mRNA-LNP 新冠疫苗均能 诱导产生高水平的 IgG 滴度和抗体中和反应。

带状疱疹疫苗:具有巨大未满足需求的蓝海市场
中国有着最大的目标群体,仅有一款进口产品获批
带状疱疹(Herpes zoster, HZ),是由潜伏在体内的水痘-带状疱疹病毒(Varicella zoster virus, VZV)再激活而引起的一种急性感染性皮肤疾病。儿童时期初次感染 VZV 引 起水痘,感染后病毒进入皮肤的感觉神经末梢,沿着脊髓后根或三叉神经节神经纤维向中 心移动,以一种持久潜伏的形式长期存在与脊神经或颅神经感觉神经节中。当人体免疫力低下或受到非特异性刺激后,病毒再次活动,生长繁殖,导致受侵犯的神经节发炎或坏死, 产生神经痛(PHN)。
所有得过水痘的人群都可能会得带状疱疹,且随着年龄增长患病风险升高。根据 WHO 数据,带状疱疹的年发生率约为 3‰~10‰,80 岁以上人群发病率可高达 8‰~10‰。普 通人一生中得带状疱疹的概率高达 30%,而得带状疱疹的人群 10%-34%会产生神经痛 (PHN),30%~50%的 PHN 患者疼痛持续超过 1 年,部分病程可达 10 年或更长,接种 疫苗是最有效可行的预防手段。根据美国 CDC,全球最早的带状疱疹减毒活疫苗于 2006 年在美国获批上市,上市后美国 60 岁以上老年人接种率从 2008 年的 6.7%提高到 2018 年的 34.5%,中国 2020 年才有 GSK 的重组疫苗 Shingrix 上市销售,潜在未满足需求的 人群数量巨大。
国际上 MSD 和 GSK 分庭抗礼,国内 GSK 一家独大。最早的带状疱疹疫苗为减毒活 疫苗,于 2006 年上市。GSK 的重组蛋白疫苗 2017 年获 FDA 批准上市,之后于 2020 年 在中国实现上市销售。根据 Lecrenier N, Beukelaers P, Colindres R, et al. Development of adjuvanted recombinant zoster vaccine and its implications for shingles prevention[J]. Expert Rev Vaccines, 2018, 17(7): 619‐634. DOI: 0.1080/14760584.2018.1495565, Shingrix 对于 50-59 岁人群预防带状疱疹有效性达到 96.6%,60-69 岁人群有效性达到 97.4%,有效性整体高于 Zostavax,但 Zostavax 对比 Shingrix 安全性更高。2020 年 11 月 18 日起,减毒活带状疱疹疫苗(Zostavax)已不再在美国使用,因此目前在美国市场 销售的只有 GSK 的 Shingrix。
依托自研新型佐剂,GSK 重组带状疱疹疫苗后来居上。Shingrix 为重组蛋白疫苗, 所使用的佐剂为 GSK 自研的 AS01 佐剂,包含两种成分免疫刺激剂单磷酸酰脂质 A(MPL) 和皂树皂苷 QS-21,MPL 通过 Toll 样受体 4(TLR4)激活天然免疫系统,QS-21 能激活 被膜下淋巴窦巨噬细胞(SSMs)中的半胱天冬酶 1(Caspase 1),两种成分都可以激活机 体的先天免疫反应,显著提高 Shingrix 的免疫原性。Shingrix 卓越的临床保护效力使其在 上市后迅速挤占 Zostavax 的市场份额,创造远超 Zostavax 的销售额。GSK 的带状疱疹 疫苗 2022 上年销售额 14.29 亿英镑,有望成为全球销售前三的疫苗品种(不考虑新冠疫 苗,仅次于 HPV 疫苗和 13 价肺炎疫苗),GSK 目标是在 2026 年实现约 40 亿英镑的销 售额。
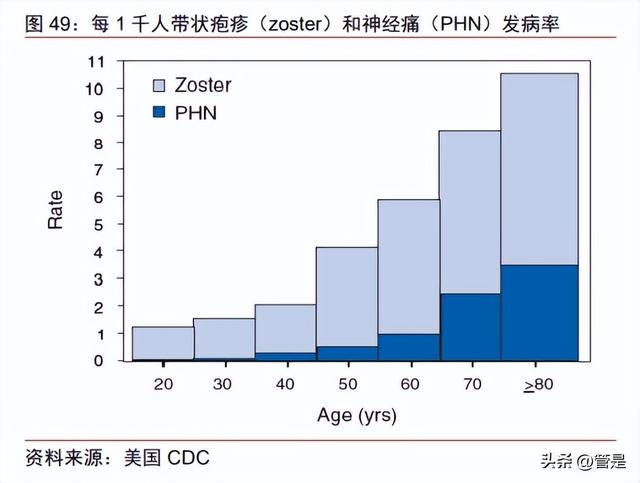
公司基于自研佐剂的重组带状疱疹疫苗具有稀缺性
目前国内在研重组带状疱疹疫苗进入临床阶段的共有 6 款,进展最快的为百克生物的 减毒活疫苗,上市许可申请于 2022 年 4 月获得受理,此外上海所的减毒活疫苗进入临床 II 期。重组蛋白疫苗路线进展最快的为绿竹生物,于 2022 年 4 月 19 日启动 II 期临床试验, 而大多数公司在临床前或刚获批临床。在所用佐剂上除了迈科康生物使用自研的 MA105 佐剂外,其他大多使用铝佐剂或 CpG 佐剂,瑞科生物使用自研的能够对标 AS01 (MPL+QS-21)的新型佐剂具有稀缺性。根据公司 2022 年 12 月 19 日公告,新佐剂重 组带状疱疹疫苗 REC610 获得菲律宾国家食品药品监督管理局的临床试验批准。
公司新型佐剂重组带状疱疹疫苗 REC610 由带状疱疹病毒糖蛋白 E(gE)和基于脂 质体的佐剂系统组成。gE 是带状疱疹病毒复制的必要条件,佐剂系统通过激活先天免疫 系统,同时诱导 gE 特异性细胞因子以产生 CD4 +T 细胞以及 gE 特异性抗体。REC610 可 引起较高滴度的体液免疫和细胞免疫反应。REC610 免疫原性非劣于 Shingrix。公司采用重组蛋白疫苗技术路线,并使用能够 对标 AS01(MPL+QS-21)的新型佐剂,在动物研究中显示出非劣于 Shingrix 的免疫原 性,与 Shingrix 相比,REC610 的 IFN-γ 及 IL-2+IFN-γ 水平更高。公司预计于 2024 年提交 BLA 申请。
盈利预测
1)收入端:按照产品管线对业务进行拆分 重组新冠疫苗(ReCOV):公司重组新冠肺炎疫苗 ReCOV 目前正开展全球多中心基 础免疫的临床 III 期试验,在阿联酋开展序贯免疫的临床 II/III 期试验,与辉瑞 mRNA 疫苗 的对比研究取得优效。我们预期公司重组新冠肺炎疫苗 ReCOV2023 年实现上市销售,上 市成功概率为 80%,经风险调整后 2022-2024 年销售收入预计分别为 0、80、120 百万 元,假设毛利率稳定在 85%,对应毛利润分别为 0、68、102 百万元。 HPV 疫苗(REC603/REC604a/REC601/REC602):公司九价 HPV 疫苗(REC603) 主效力试验 2022 年 5 月完成三针给药,随访 36 个月取得期中分析条件,公司预计 2025 年提交BLA申请,2026年实现上市销售,上市概率为80%。
公司四价HPV疫苗(REC604a) IND 申请获得受理,我们预计 2028 年实现上市销售,上市概率为 30%。公司二价格 HPV 疫苗(REC601/REC602)处于临床 I 期阶段,我们预计 2027 年实现上市销售,上市概 率为 80%。具体盈利预测详见下表。 重组带状疱疹疫苗(REC610):公司采用重组蛋白疫苗技术路线,并使用能够对标 AS01(MPL+QS-21)的新型佐剂,在动物研究中显示出非劣于 Shingrix 的免疫原性,与 Shingrix 相比,REC610 的 IFN-γ及 IL-2+IFN-γ水平更高。REC610 于 2022 年底获得 临床试验批准,我们预计 2028 年实现上市销售,上市概率为 60%。
(本文仅供参考,不代表我们的任何投资建议。如需使用相关信息,请参阅报告原文。)
精选报告来源:【未来智库】「链接」
相关参考