强碱制弱碱的原理(IB化学SL知识点简单介绍)
Posted
篇首语:最是人间留不住,朱颜辞镜花辞树。本文由小常识网(cha138.com)小编为大家整理,主要介绍了强碱制弱碱的原理(IB化学SL知识点简单介绍)相关的知识,希望对你有一定的参考价值。
强碱制弱碱的原理(IB化学SL知识点简单介绍)
IB大考正在进行中,5月18号就要迎来化学学科的考试了,是时候检验同学们两年多的准备与学习啦!现在我们就来回顾一下化学11个章节中重要的概念吧,每个章节我都截取了IB化学SL知识点要点,大家可以检查一下这22个基本要点是不是都掌握了~
Topic 1 stoichiometric relationship
第一章的内容不多,主要的只有理想气体公式与error的判定。
1. Ideal gas law
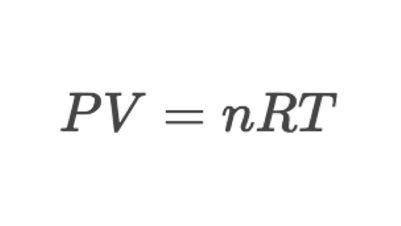
同学们在使用这个公式计算的时候,一定要注意单位!当pressure的单位是kPa的时候,volume的单位是dm³;当pressure的单位是Pa的时候,volume的单位是m³。单位的换算是很容易出错的点。
2. Error
下面有一张图可以很直观地帮助大家判断error的类型,究竟是random error还是systematic error。Random是分散但是准确的,systematic是聚拢但是不准确的。

Topic 2 atomic structure
1. Isotope 同位素
同位素的定义经常会考到,只需要写到两个要点即可得分:same proton number / different neutron number。
2. Exception in electron configuration
有一些元素的核外电子排布方式是例外情况,最常被考到的是24号铬元素和29号铜元素的核外电子排布方式以及原因。以下是答题的模板~
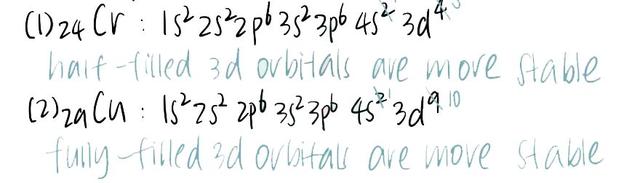
Topic 3 periodic table
第三章的重要内容是元素周期表内元素特性的规律与趋势,一张表格就可以很清晰地总结~这些你都掌握了吗?

Topic 4 chemical bonding and structure
在第四章中,我们学习了3种bond与3种intermolecular force,现在我们来回顾一下吧!
1. Bonding
-Ionic bond: electrostatic force of attraction between cations and anions
-Covalent bond: electrostatic force of attraction between nuclei and shared electrons
-Metallic bond: electrostatic force of attraction between metal ion and free-moving electrons
2. Intermolecular force
-LDF (London dispersion force): 瞬间的
-DDF (dipole-dipole force):长久的,但是LDF的效果会覆盖DDF的效果
-Hydrogen bond 氢键:比LDF和DDF都强的力,相当于放大版的DDF(定义:forces between high EN atom and H atom bonded to another high EN atom)
Topic 5 thermochemistry
1. Energy level profile
我们先来看两张energy level profile,大家能分辨出哪个图代表了endothermic reaction,哪个是exothermic 吗?
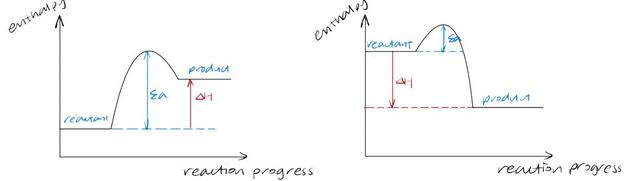
左边的图中product的enthalpy更高,所以是absorb heat,代表了endothermic reaction,右边的图相反。
2. Hess’s law
对于一个化学反应,总能量变化是一定的,无论经过几步反应,或者经过什么反应路径,甚至是虚构的中间步骤。类似于物理或者数学中的向量,只要起点和终点是相同的,向量和也就相同。
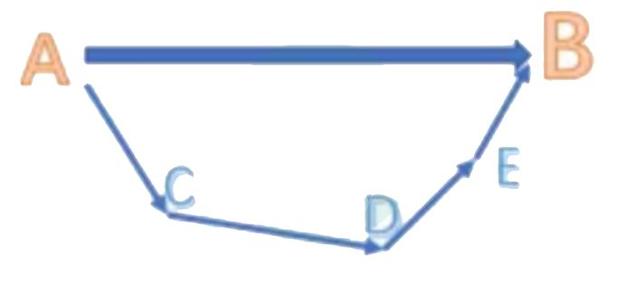
(从图中就可以很直接地看出)
Topic 6 chemical kinetics
第六章中最重要的知识点就是影响化学反应速率的四个因素了,它们分别是:反应物浓度,反应物表面积,温度,催化剂。
那这四个因素与反应速率的关系是怎样的呢?

其中,IB经常会问到温度与反应速率的正比例关系的原因,只需要写到 average kinetic energy increase, more particles have E>=Ea 即可。
Topic 7 equilibrium
1. Equilibrium
如标题所示,第七章最重要的概念就是equilibrium啦。化学反应总是自发的由化学势总和较高的一方到低的一方,直至两方的化学势相等,抵达平衡点。
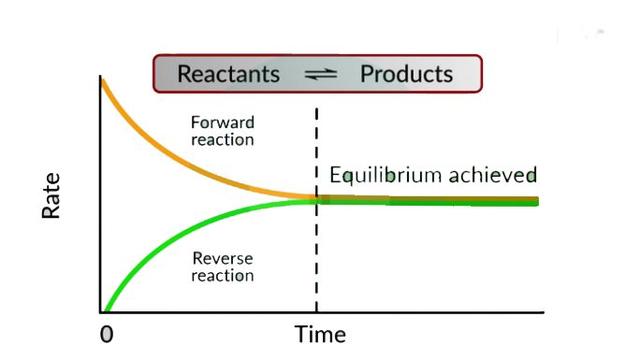
2. 化学反应的方向——Le Chatelier 原理
乐夏特列定理也是第七章中极为重要的定理。它的定义是:“把平衡的某一因素加以改变之后,将使平衡向抵消外来因素改变的效果的方向转移。When a system at equilibrium is subjected to a change, the system will respond in a way to minimize its effect of its change.”
平衡状态下:
-增加(减少)某成分的浓度,平衡向减小 (增加)其浓度的方向移动。
-增大(减少)压力,平衡向气体分子数减少 (增大)的方向移动。
-温度升高(降低),平衡向吸热(放热)的方向移动。
PS.第七章equilibrium 的主要内容是how far from the reactant to product,而第六章 Kinetics是讲how fast of a reaction is。以下是一些易错点:
-注意equilibrium position 以及equilibrium constant 的分别。
- equilibrium position会受温度,浓度,压强的影响,不受催化剂的影响。但equilibrium - constant 只受温度影响。
- 注意equilibrium constant(K)以及reaction quotient(Q)的分别,前者是product 与reactant在反应到达equilibrium position时的比例,后者是product 与reactant在反应任何时间的比例。
Topic 8 acid and bases
1. 强酸/弱酸/强碱/弱碱
在这一章中需要背诵好常见的Strong/weak acid/base。在考试看见对应的化学品就知道是强弱的酸碱,从而知道如何计算pH。
强酸/碱与弱酸/碱的区别在于:前者在溶液中能够完全分离(completely dissociate),后者在溶液中只是部分分离 (partially dissociate).
我们来看一些常考的例子吧:
强酸:盐酸,硫酸,硝酸
弱酸:碳酸,乙酸
强碱:氢氧化钠,氢氧化钾,氢氧化钡
弱碱:氨气
2. 常见公式
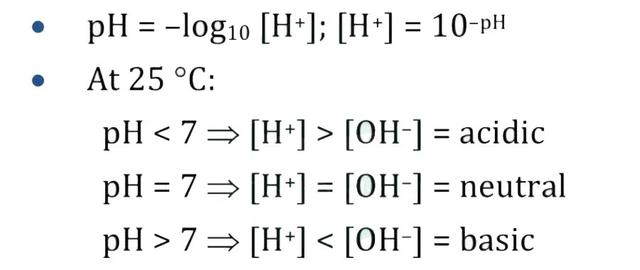
Topic 9 redox reaction
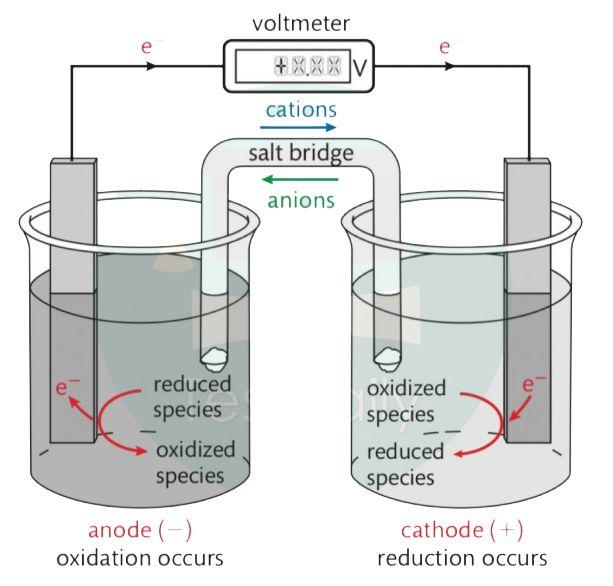
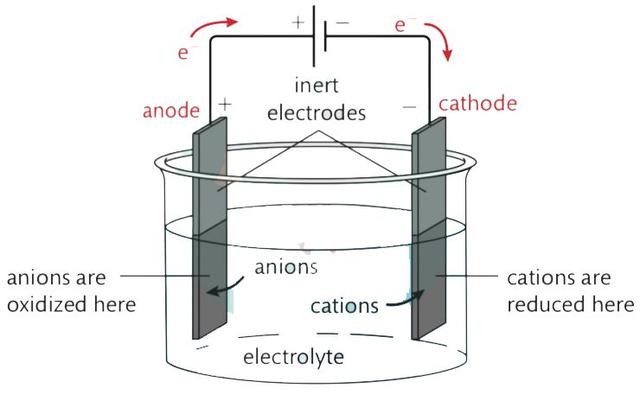
这一章中一定要注意voltaic cell 以及electrolysis cell 的区别,看清楚题目是讲哪一种cell,下面两张图片能很好地总结所有有关cell的知识点啦。
1. Voltaic cell(由化学能转换为电能)
2. Electrolytic cell(由电能转换为化学能)
Topic 10 organic chemistry
这个章节要靠背诵的挺多,尤其是各种反应的条件、用途等等。每一个反应都要问问自己这些会了吗?(chemical equation, type of reaction, reaction condition, mechanism, observation),建议合上书把这些都整理在下面的flow chat里面去。
同时,第10章也是经常考大题的章节。有一些注意点需要提醒考前的大家~
留意常见的词汇:
-Conditions vs reagents vs reactants的分别
-化学品的用途
(Nucleophile/electrophile/acid/base/solvent/catalyst/intermediate)
-字眼 “Excess” 的使用
考试时以下字眼的分别:
-Draw a mechanism vs write an equation
-Give the major organic products
-Draw skeletal/condensed/displayed formula
Topic 11 measurement, data processing, analysis
这个章节很多同学觉得很难,幸好出的题目也不算很多。
在mass spectrum,通常会考最右边的molecular peak。
在IR spectrum, 最常考C=0 的peak,因为这个可以是ketone, aldehyde, carboxylic acid,以及ester,可以考的内容比较丰富,考官很喜欢出这个。
写在最后
希望大家能调整心态,积极应试!在IB考试中,总会有一小部分是“挑战题”,这时候心态不要崩,因为要相信剩下的大约 95% 都是你在学习和练习后有信心能够做对的题目。
最后,希望我的干货能帮到你,祝大家都能在IB化学大考中获得好成绩!
相关参考
...水中能与强酸发生中和作用的物质的总量。这类物质包括强碱、弱碱、强碱弱酸盐等。天然水中的碱度主要是由重碳酸盐、碳酸盐和氢氧化物引起的,其中重碳酸
溶液稀释解题技巧对于PH相同的强酸和弱酸(强碱和弱碱)溶液稀释相同倍数,强酸(强碱)的溶液的PH变化幅度大,这是因为强酸(强碱)已经完全电离(在中学被认为是)随着加水稀释,溶液中的氢离子和氢氧根离子(除水...
有没有强碱制弱碱的说法(聚乙烯醇缩丁醛(PVB树脂)有效分解-天元航材)
pvb树脂又叫聚乙烯醇缩丁醛树脂,是一种通过人工成本分解的高分子。PVB树脂的用途多,小编接上去给大家讲一讲就是它是我们如何有效分解的:1、对金属、塑料、玻璃、陶瓷、木材、纸张、皮革、水泥等各种底材均有一个优...
强酸先和强碱还是弱碱反应(高考化学:化学实验的操作方法描述)
1.装置气密性的检查: (1)如图A:将导管出口浸入水中,用手掌或热毛巾T捂住烧瓶位,水中的管口有气泡溢出(装有分液漏斗的要将其开关关好)过一会儿移开捂的手掌或毛巾,导管末端有一段水柱,说明装置不漏气。 (2)...
...况下,强电解质是指电离度在30%以上的电解质,如强酸、强碱和大部分盐。弱电解质是指电离度在30%以下的电解质,如弱酸和弱碱。 通常认为某酸或碱的电离常数K(25°C)>1则为强酸或强碱,即强电解质;电离常数K=10-4<K<1为...
弱酸弱碱盐显什么性怎么判断(高中化学电离平衡的九个重要知识点)
高中化学电离平衡的九个重要知识点,高考高分必看~希望对大家有所帮助,提高复习效率。概念必须准确理解含义理解原理才能灵活应用酸碱强弱看电离常数一眼便知水电离指示剂变色范围混合液酸碱性判断酸碱性判断酸碱性...
某一元弱碱Q在强碱条件下可分解(有一种“咳嗽”,止咳药无效)
咳嗽就用止咳药?有一种咳嗽止咳药无效!那就是胃食管反流性咳嗽是指胃酸和其他胃内容物反流入食管,致以慢性咳嗽为唯一或主要症状的临床综合征,是一种特殊类型的胃食管反流性疾病,又称反流性咳嗽综合征,是慢性咳...
氢氧化铝在空气中灼烧(高考化学丨十类常考试剂的性质和用途归纳)
1.去污剂:水解呈碱性的强碱弱酸盐在生产生活中常作去污剂。例如Na2CO3水溶液因弱酸根离子(CO32-)水解呈碱性;而油污在碱性条件下水解生成可溶性羧酸盐和甘油,从而达到去油污的目的。另外,由于强碱弱酸盐(Na2CO3)水...
七、盐类的水解(只有可溶于水的盐才水解)1、盐类水解:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。2、水解的实质:水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合,破坏水的电离,...
#教育听我说#在高中化学中盐也是一类常见的很重要的物质。今天我就简单谈谈高中化学中的盐类。一、盐的定义:盐是指在水溶液中电离出酸根阴离子和金属阳离子或铵根阳离子的化合物。附:(1)酸根阴离子指除氢氧根离子...