弱酸 强酸(「解题策略」利用“交叉”规律分析“强酸制取弱酸”原理)
Posted
篇首语:仰天大笑出门去,我辈岂是蓬蒿人。本文由小常识网(cha138.com)小编为大家整理,主要介绍了弱酸 强酸(「解题策略」利用“交叉”规律分析“强酸制取弱酸”原理)相关的知识,希望对你有一定的参考价值。
弱酸 强酸(「解题策略」利用“交叉”规律分析“强酸制取弱酸”原理)
【解题策略】利用“交叉”规律分析“强酸制取弱酸”原理
利用“交叉”规律分析“强酸制取弱酸”原理
学生对强酸制取弱酸规律并不陌生,可当给定反应物酸“过量”或“少量”时,学生往往对于生成的盐是“正盐”还是“酸式盐”搞不清楚.

例2 (1)向Na2CO3溶液中加入少量HF溶液,反应离子方程式为 (数据参照表1 ,下同);若加入过量HF溶液,反应离子方程式为 ;
(2)向NaCN 溶液中通入少量的CO2,反应离子方程式为 .
分析:依据“强酸+弱酸盐=弱酸+强酸盐”原理,将该原理转变成“交叉”形式如下:

称之为“交叉”规律(实线连接的为反应物,虚线连接的为生成物),这样一来,反应的生成物一目了然. 它直观体现了反应原理中的“以强制弱”原理,该“交叉”规律也适用于氧化还原反应.
由表1数据,得出下面的结论及形式:
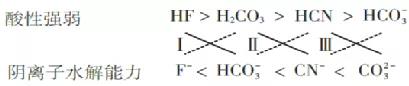
依据“交叉”规律易知反应有:
(Ⅰ)HF+HCO3-=F-+CO2 ↑+H2O;
(Ⅱ)CO2+H2O+ CN-= HCO3-+HCN(不论CO2多与少,都只生成HCO3-);
(Ⅲ)HCN+ CO32- = HCO3-+CN-(不论HCN多与少,都只生成HCO3-).
亦有结论:(Ⅳ)HF+CN-=F-+HCN;(Ⅴ)HF(少量)+ CO32-= HCO3-+F-.
若加入过量的HF 溶液,则为2HF(过量)+ CO32- =2F-+CO2↑+H2O.这是因为反应(Ⅴ)生成的NaHCO3再与多余HF发生反应(Ⅰ)HF+HCO3-=F-+CO2↑+H2O,合并得2HF(过量)+ CO32- =2F-+CO2↑+H2O.
相关参考