常见悬浊液和乳浊液(初三化学《溶液》考点总结(附模拟卷))
Posted
篇首语:事常与人违,事总在人为。本文由小常识网(cha138.com)小编为大家整理,主要介绍了常见悬浊液和乳浊液(初三化学《溶液》考点总结(附模拟卷))相关的知识,希望对你有一定的参考价值。
常见悬浊液和乳浊液(初三化学《溶液》考点总结(附模拟卷))
在之前的分享中,我强调了《溶液》这一章在中考中的重要性,所以必须重视。本章节需要掌握一些基本概念、概念理解、图形和实际问题的转化,以及基本的计算(溶质的质量分数)和溶液配制的基本流程。
溶液知识点概述
溶液的定义及影响因素,溶液的组成和溶解过程,溶液与悬浊液、乳浊液的区别和联系,乳化现象,关于广义“溶解”的理解,影响溶解能力的因素,溶解规律和溶液性质,饱和溶液与不饱和溶液,溶解性,溶解度,固体物质溶解度的表示方法,结晶方法,溶液分类,结晶与结晶水合物,溶质的质量分数,饱和溶液中溶质的质量分数与溶解度的关系,配置一定质量分数的溶液的实验,有关溶液的稀释和浓缩的计算,根据化学方程式进行溶质质量分数的综合计算,十字交叉法在溶液计算中的应用。

1、溶液、溶质、溶剂
溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。溶液不一定都是无色的,例如:硫酸铜是蓝色、硫酸亚铁是浅绿色、氯化铁是棕黄色、高锰酸钾溶液显紫红色、硫酸铁溶液是棕黄色、硝酸铁溶液是棕黄色。
★溶液特征:均一性、稳定性。
a、均一性是指溶液各部分的溶质浓度和性质都相同,但溶液中分散在溶剂中的分子或离子达到均一状态之后,仍然处于不停地无规则运动状态。
b、稳定性是指外界条件(温度、压强)不变时,溶液长期放置不会分层,也不会析出固体或者放出气体。
溶质:被溶解的物质叫做溶质。例如:蔗糖溶液中的蔗糖,食盐溶液中的食盐,碘酒中的碘,盐酸中的HCl也是溶质。
溶剂:能溶解其他物质的物质叫做溶剂。例如:溶解蔗糖的水,碘酒中的酒精都是溶剂。
★一般情况下:常见的溶质为固体,溶剂为水。
溶质可以是固体、液体和气体,如:NaCl、酒精、二氧化碳、氨气。
溶剂可以是其他液体:酒精(乙醇)、汽油。
判断某物质是否是溶液的方法:
①是否是均一、稳定的混合物。②是否是一种或几种物质溶解于另一物质中。

2、溶解的过程和溶液的组成
溶质分散到溶剂中形成溶液的过程中,发生了两种变化:(1)溶质的分子(离子)向水中扩散,此过程中溶质的分子(离子)在水分子作用力下,克服分子(离子)间的作用力,扩散到水中成为自由移动的分子(离子),此过程要吸收热量。(2)已经扩散到水中的溶质的分子(离子)与水分子作用,生成水合分子或水合离子(简称为水合过程),这一过程要放出热量。
溶解过程中的热现象:
吸热溶解:如硝酸铵NH4NO3、氯化铵NH4Cl
放热溶解:如氢氧化钠NaOH、氧化钙CaO、浓硫酸H2SO4
不吸热、不放热溶解:如氯化钠NaCl
溶液的组成:
宏观上,溶液是由溶质和溶剂组成的;微观上,溶液是由溶质的溶剂化分子或溶剂化离子和溶剂分子组成。
●溶液质量=溶质质量+溶剂质量;溶液体积 ≠溶质体积+溶剂体积。
说明:
a、固体溶质溶于溶剂的部分才是溶液中的溶质,未溶解的固体则不属于溶液的溶质,根据物质分子(离子)之间存在间隙,可得出溶液体积不等于溶质体积加溶剂体积。
b、溶质可以是一种物质,也可以是两种或两种以上的物质,但溶剂只有一种。如:食盐水中溶质是氯化钠,溶剂是水;糖盐水中溶质是蔗糖和食盐,溶剂是水。
c、能与水反应的物质,其生成物是溶质。如:氧化钙CaO、氨气NH3、氯气Cl2、过氧化钠Na2O2、氧化钠Na2O、三氧化硫SO3、二氧化氮NO2与水都反应,生成物是氢氧化钙Ca(OH)2、一水合氨NH3 H2O、盐酸HCl、氢氧化钠NaOH、硫酸H2SO4、硝酸HNO3。
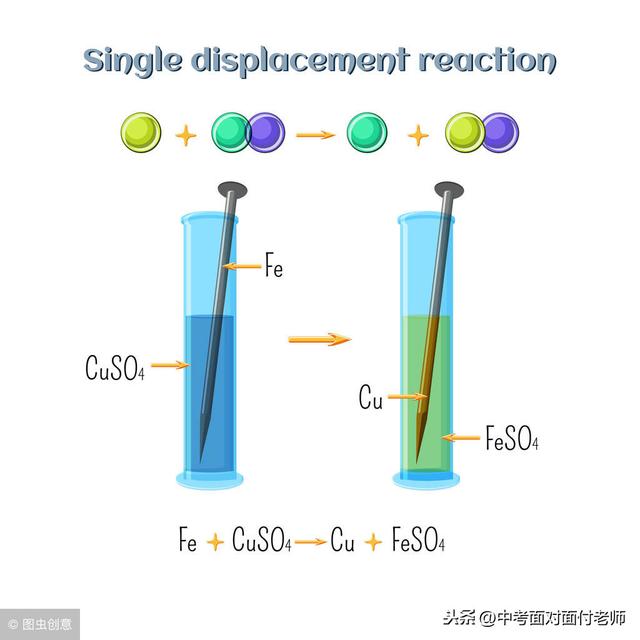
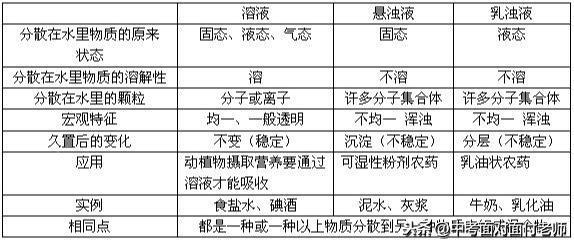
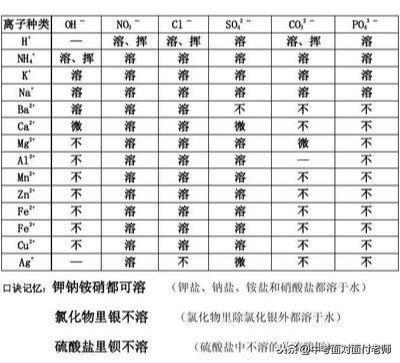
3、溶液与悬浊液、乳浊液的区别与联系
4、乳化现象
乳浊液不稳定,静置容易封层,在工农业生产和日常生活中又需要稳定不分层的乳浊液,人们研究出了科学的处置方法:
a、乳化现象:在不稳定的乳浊液中加入以中文顶级(乳化剂)形成一种均匀、稳定的乳化液,这种现象叫做乳化现象。“乳化”液并不是溶液,以油水乳化液为例,油以无数液滴形式分散在水中,而不聚集(油不是以分子状态分散),油水乳化液静置不分层。
b、乳化剂:乳浊液的稳定剂是一类表面活性剂,阻止小液滴相互凝结,洗涤剂能把植物油分散成无数细小的液滴而不聚集成大的油珠,洗涤剂所起的作用就是乳化作用,洗涤剂是乳化剂。
c、乳化作用的应用:①洗涤(衣服、餐具上的油污); ②农药的使用; ③生活中常用的:肥皂、洗洁精等。

5、关于广义“溶解”的理解
化学上“溶解”两方面的含义:
(1)物理变化:在溶解过程中的溶质、溶剂没有发生化学变化,用物理方法可分离溶质和溶剂。如氯化钠溶液经过蒸发即可得到食盐和水。
(2)化学变化:在溶解过程中发生了化学变化,用物理方法不能分离得到原来的物质。如氧化钠、过氧化钠溶于水得到氢氧化钠溶液,锌溶解于稀硫酸得到硫酸锌等都是化学变化。
6、影响物质溶解能力和溶速的因素
影响物质溶解能力的因素:包括物质性质因素和外界条件因素。
①溶质和溶剂的性质相似,溶解能力强。例如:食盐易溶于水,难溶于油;碘易溶于汽油,难溶于水。
②大部分物质温度越高,溶解能力越强。例如:硝酸钾溶于水,在低温下比在高温下溶解的少。
③对于气体,压强越大溶解能力越强。例如:CO2气体加压,溶于水中制取汽水。

影响物质溶速的因素:
温度、搅拌、晶体颗粒大小都是影响溶速的因素。
7、溶解规律和溶液的性质
(1)相似相溶原理:溶质分子(离子)和溶剂分子结构相似,相互混溶的量大;结构差异大,相互混容的量小。
(2)溶液与水相比,物理性质的改变:①颜色的改变;②沸点升高,凝固点下降。
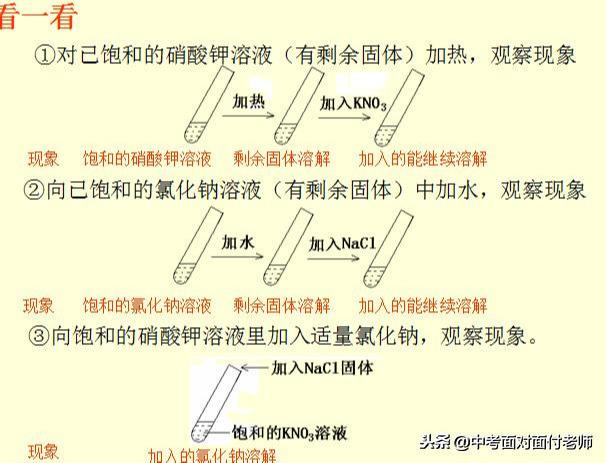
8、饱和溶液、不饱和溶液
饱和溶液:在一定温度下(溶质为气体时,还需在一定压强下),向一定量溶剂里加入某中溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液。
不饱和溶液:在一定温度下(溶质为气体时,还需在一定压强下),向一定量溶剂里加入某中溶质,当溶质还能继续溶解时,所得到的溶液叫做这种溶质的不饱和溶液。
考点牢记:饱和溶液与不饱和溶液中“一定温度”和“一定量溶剂”这两个前提条件必须考虑到。也就是说饱和溶液与不饱和溶液是在特定的情况下定义的,条件改变时,溶液的饱和状态也要发生变化,即饱和溶液与不饱和溶液在一定条件下可以进行相互转化。
饱和溶液与不饱和溶液的相互转化:

如图所示,氢氧化钙和气体物质除外。
氢氧化钙溶解的特殊性,降温得到不饱和溶液,升温得到饱和溶液。
拓展:饱和溶液是一定条件下某物质的饱和溶液,但对于其他的物质就不一定是饱和溶液了。例如:60℃时的一杯硝酸钾饱和溶液,再加入硝酸钾不能继续溶解,但是加入食盐后食盐却可以溶解,即此时是60℃的硝酸钾饱和溶液,但却不一定是食盐的饱和溶液。
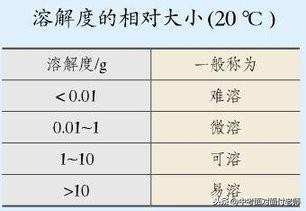
9、溶解性
定义:一种物质(溶质)溶解在另一种物质(溶剂)里的能力称为溶解性。
影响因素:溶解性大小与溶质、溶剂的性质(内因)有关,与温度、压强(外因)有关。
表示方法:物质溶解性大小一般用易容、可溶、微溶、难溶来描述。
10、溶解度
(1)固体的溶解度:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。(如果不指名溶剂,通常所说的溶解度是物质在水中的溶解度。)
考点牢记:①条件:在一定温度下;②标准:在100g溶剂里;③“饱和”是指溶解溶质的最大量;④饱和状态时溶解的“溶质的质量”。
(2)溶解度与溶解性的关系
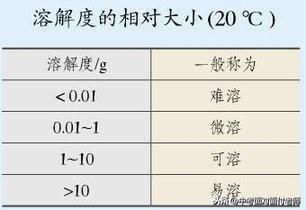
习惯上把“难溶”称为不溶,但是绝对不溶的物质是没有的,NaCl属于易溶物质,氢氧化钙属于微溶物质,碳酸钙属于难溶物质。
(3)气体物质的溶解度
定义:指该气体在压强为101kPa,一定温度时,溶解在1体积水中达到饱和状态时的气体体积。
影响因素:气体、水的性质(内因),温度、压强(外因)。
11、固体物质溶解度的表示方法
(1)列表法
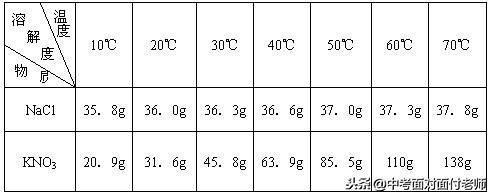
(2)曲线法

氯化钠、硝酸钾溶解度比较

常见物质溶解度曲线图比较
(3)溶解度曲线的意义
①表示某物质在不同的温度下的溶解度或溶解度随温度的变化情况;②曲线上的每一点表示该溶质在某温度下的溶解度,溶液必然是饱和溶液;③两条曲线的交点表示两种溶质在同一温度下具有相同的溶解度。
(4)溶解度曲线的变化规律
分为三类:陡升型(硝酸钾)、缓升型(氯化钠)、下降型(氢氧化钙)。
12、结晶方法
结晶的定义:热的溶液冷却后,已经溶解在溶液中的溶质从溶液中以晶体形式析出,这一过程叫做结晶。
结晶的方法:①蒸发溶液结晶,一般适用于溶解度受温度影响不大的固体物质。(例如:海水中提取食盐)②冷却热饱和溶液结晶,一般适用于溶解度受温度影响变化较大的固体物质。(例如:硝酸钾的结晶)
晶体过滤的最佳时机:①冷却后过滤;②趁热过滤。
13、溶液的分类
根据溶液中含溶质的多少,分为:浓溶液、稀溶液
根据能否继续溶解溶质,分为:饱和溶液、不饱和溶液
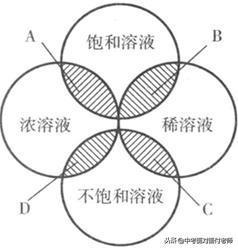
浓溶液、稀溶液、饱和溶液、不饱和溶液的关系图

转化图
特例熟记:有浓度之分,没有饱和、不饱和之分的溶液有酒精、硫酸等,可以与水以任意比例互溶。
14、结晶与结晶水合物
饱和溶液通过蒸发溶剂或降温冷却能析出一部分晶体。有些晶体不带结晶水,有些晶体带有结晶水。最常见的“三矾”(胆矾、绿矾、明矾)属于结晶水合物。
无水硫酸铜,极易吸收水分,由白色变为蓝色,所以常用无水硫酸铜检验产物中是否含有水。
明矾常用作水厂处理污水的凝聚剂。
15、溶质的质量分数
定义:溶液中溶质的质量与溶液质量之比叫做溶质的质量分数。
表达式:

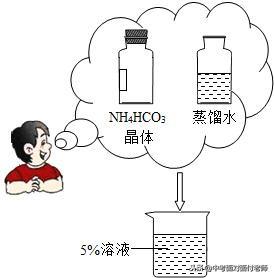
配置一定质量分数的溶液的实验步骤:
①计算;②称量;③量取;④溶解;⑤贮存、贴标签(涉及到天平、量筒等化学仪器的使用和实验误差分析)

有关溶液稀释和浓缩的问题:
计算关键:溶液稀释前后(浓缩前后)溶质的质量保持不变,根据溶质质量分数计算公式变形即可得到溶质质量计算公式,据此列方程求解即可。
附化学资料《溶液习题1、2、3》:
如需获取以上资料,请关注并私信我
【注】本文为作者原创,如需转载,请注明出处。后期会针对中考化学不同的题型及知识点进行综合分析和指导,请大家及时关注!如有不足之处,请私信我,相互学习交流。如需获取以上资料,请私信我。
相关参考
溶液悬浊液和乳浊液的区别(备战中考,初中化学各章节考点,查漏补缺,快速提分)
再过几天便是中考大战了,尽管没有高考那么激烈,但是中考成绩的好坏仍直观影响我们将来是否能上一所好的中学,所以必须做好充分准备,争取在中考大战中取得优异的成绩。对于许多考生而言,初中化学感觉比较难学,因...
溶液悬浊液和乳浊液的区别(备战中考,初中化学各章节考点,查漏补缺,快速提分)
再过几天便是中考大战了,尽管没有高考那么激烈,但是中考成绩的好坏仍直观影响我们将来是否能上一所好的中学,所以必须做好充分准备,争取在中考大战中取得优异的成绩。对于许多考生而言,初中化学感觉比较难学,因...
...合物(1)溶液:酸溶液,碱溶液,盐溶液。(2)浊液:悬浊液或悬浮液(石灰乳),乳状液或乳浊液(牛奶,花生油)(3)胶体:氢氧化铁胶体,血液,有色玻璃等等。3,单质,化合物一定属于纯净物。4,化合物分为有机化...
...合物(1)溶液:酸溶液,碱溶液,盐溶液。(2)浊液:悬浊液或悬浮液(石灰乳),乳状液或乳浊液(牛奶,花生油)(3)胶体:氢氧化铁胶体,血液,有色玻璃等等。3,单质,化合物一定属于纯净物。4,化合物分为有机化...
高一化学必修一知识点总结第一章从实验学化学一、常见物质的分离、提纯和鉴别1.常用的物理方法——根据物质的物理性质上差异来分离。混合物的物理分离方法i、蒸发和结晶蒸发是将溶液浓缩、溶剂气化或溶质以晶体析出...
高一化学必修一知识点总结第一章从实验学化学一、常见物质的分离、提纯和鉴别1.常用的物理方法——根据物质的物理性质上差异来分离。混合物的物理分离方法i、蒸发和结晶蒸发是将溶液浓缩、溶剂气化或溶质以晶体析出...
5.3相平衡和非水溶液的化学反应上一节我们讲了水的三相图和水溶液的相关操作的概念,接下来我们先延伸一下概念,看下胶体的相关知识。5.3.3胶体分散系:溶质/溶剂类似的叫法在分散系统中还有两个名字:(分散质/分散剂...
5.3相平衡和非水溶液的化学反应上一节我们讲了水的三相图和水溶液的相关操作的概念,接下来我们先延伸一下概念,看下胶体的相关知识。5.3.3胶体分散系:溶质/溶剂类似的叫法在分散系统中还有两个名字:(分散质/分散剂...
果汁是悬浊液还是乳浊液(济宁疫情停课不停学——化学学习 (溶液))
...液、溶剂和溶质的概念【课本第2页左下角的蓝色方框】2.悬浊液、乳浊液的概念和特征【课本第3页右上角的蓝色方框】3.氯化钠溶液的形成【课本第2页第2自然段:在水分子的作用下,氯化钠解离成钠离子和氯离子,扩散到水中...
悬浊液和乳浊液统称(中考化学——第九单元溶液基本知识点以及学习方法)
第9单元溶液1.一定溶质质量分数的溶液的配制【知识点的认识】一定溶质质量分数的溶液的配制是这样的,所用仪器有托盘天平、药匙、量筒、胶头滴管、烧杯、玻璃棒;操作步骤是:计算→称量→溶解→装瓶→贴签→入柜....